Colite Pseudomembranosa - Infecção por Clostridioides difficile - ICD
Fatores de risco para infecção por Clostridioides difficile (ICD)
Microbiologia do Clostridioides difficile (ICD)
Manifestações clínicas da Infecção por Clostridioides difficile
Diagnóstico da Infecção por Clostridioides difficile (ICD)
Exames de diagnóstico auxiliares para Infecção por Clostridioides difficile (ICD)
Diagnóstico diferencial da Infecção por Clostridioides difficile (ICD)
Tratamento e Prevenção da Infecção por Clostridioides difficile (ICD)
Avaliação da gravidade da infecção por Clostridioides difficile (ICD)
Tratamento da infecção por Clostridioides difficile (ICD)
Tratamento da Infecção por Clostridioides difficile leve a moderada
Tratamento da Infecção por Clostridioides difficile grave
Cirurgia no tratamento da Infecção por Clostridioides difficile grave
Episódio recorrente da Infecção por Clostridioides difficile (ICD)
Tratamento colite fulminante por Clostridioides difficile (ICD)
Prevenção da infecção por Clostridioides difficile em pacientes individuais
O uso de antibióticos é o fator de risco mais amplamente reconhecido e modificável para ICD. Outros fatores de risco estabelecidos incluem idade avançada, hospitalização e doença crônica grave.
Fatores de risco adicionais incluem alimentação enteral, cirurgia gastrointestinal, obesidade, quimioterapia para câncer, transplante de células-tronco hematopoéticas, doença inflamatória intestinal, cirrose e, possivelmente, supressão do ácido gástrico.
Os fatores de risco para ICD recorrente incluem idade >65 anos, doenças crônicas graves, necessidade de terapia contínua com antibióticos concomitantes durante o tratamento para ICD e creatinina sérica ≥1,2 mg/dL.
Os fatores de risco para complicações associadas a ICD (perfuração, megacólon tóxico, colectomia, admissão em unidade de terapia intensiva, morte) incluem idade avançada, exames de sangue anormais (contagem de leucócitos <4.000 ou ≥20.000, albumina <25 g/L, nitrogênio ureico no sangue >45 mg/dL e proteína C reativa ≥150 mg/L) e sinais vitais anormais (frequência cardíaca >90/minuto, frequência respiratória >20/minuto).
Uso de antibióticos e risco de infecção por Clostridioides difficile
Os dois papéis principais dos antibióticos na patogênese do C. difficile são: primeiro, os antibióticos alteram a barreira da microbiota colônica normal, fornecendo um nicho para o C. difficile multiplicar e produzir toxinas; segundo lugar, seleciona C. difficile resistentes à clindamicina ou fluoroquinolonas, cepas com maior virulência.
Estes são os antibióticos mais frequentemente implicados na ICD: fluoroquinolonas, clindamicina, penicilinas e cefalosporinas de amplo espectro. No entanto, qualquer antibiótico pode predispor à colonização por C. difficile, incluindo metronidazol e vancomicina, que são os principais antibióticos usados para tratar a ICD.
O uso de antimicrobianos de amplo espectro, o uso de múltiplos agentes antibióticos e o aumento da duração da antibioticoterapia contribuem para a incidência de ICD.
O risco de ICD aumenta durante a antibioticoterapia e no período de três meses após o término da terapia; o risco é maior durante o primeiro mês após o uso de antibióticos.
A profilaxia antibiótica perioperatória também confere risco de ICD, especialmente se um hospital estiver passando por um surto de ICD.
Idade avançada e risco de infecção por Clostridioides difficile
A idade está relacionada com a frequência e a gravidade da ICD. As razões para essa associação são incertas e podem ser multifatoriais. Condições comuns aos idosos, como resposta imunológica diminuída e comorbidades, aumentam o risco cumulativo de ICD e a probabilidade de necessitar de hospitalização.
Supressão do ácido gástrico e risco de infecção por Clostridioides difficile
A supressão do ácido gástrico (com inibidores da bomba de prótons [IBPs] ou antagonistas do receptor da histamina 2) aumentam o risco de ICD. O risco de ICD aumenta de 1,4 a 2,75 vezes nos pacientes em uso regular de IBPs em comparação com aqueles que não usam. A descontinuação de IBPs desnecessários é razoável, embora não haja evidências suficientes para a descontinuação de rotina de IBPs como medida de prevenção de ICD.
Este micro-organismo é agora reconhecido como a causa da colite pseudomembranosa e outras formas variantes de diarreia e colite, geralmente em pacientes que fazem ou fizeram uso de antibióticos.
Toxinas produzidas pelo Clostridioides difficile
C. difficile libera duas potentes exotoxinas que causam a colite com diarreia: toxina A e toxina B. Uma vez intracelulares, a toxina A causa inflamação levando à secreção de fluido intestinal e lesão da mucosa, ativa diretamente os neutrófilos e ambas as toxinas A e B podem promover a quimiotaxia, migração, dos neutrófilos formando as pseudomembranas.
A toxina B é importante para a virulência de C. difficile e é mais de 10 vezes mais potente do que a toxina A. Assim, as cepas sem toxina A podem ser tão virulentas quanto as cepas com ambas as toxinas. Por outro lado, cepas com produção mínima ou nenhuma de toxina B podem causar ICD; portanto, a toxina A parece também contribuir para a patogênese de ICD.
Cerca de 10 a 30 por cento dos C. difficile não é toxinogênica, e, portanto, não causam doenças.
Os anticorpos antitoxina séricos é o fator hospedeiro mais bem descrito na proteção contra o C. difficile. A colonização com cepas não toxinogênicas também oferece proteção contra a infecção por cepa de C. difficile produtora de toxina.
Infecção por Clostridioides difficile recorrente
O mecanismo de recorrência da ICD após a infecção inicial tratada não é totalmente compreendido. Pode ser devido à presença de esporos (recidiva) ou reinfecção.
A resistência aos antibióticos não parece ser um fator de recorrência. No entanto, o tratamento com metronidazol ou vancomicina para um episódio inicial de ICD pode alterar o microambiente colônico (em relação à microbiota ou outros fatores), aumentando potencialmente a suscetibilidade à reinfecção e recorrência.
Infecção por Clostridioides difficile leve a moderada
O principal sintoma de ICD não grave é a diarreia aquosa (≥ 3 evacuações em 24 horas). Outras manifestações incluem dor no abdome inferior em cólica, febre baixa, náuseas e anorexia. Muco ou sangue oculto são frequentes nas fezes amolecidas, mas melena ou hematoquezia são raras. A febre >38,5 °C pode estar presente em cerca de 15 por cento dos caso.
Os critérios laboratoriais para ICD não grave incluem contagem de leucócitos ≤15.000 células/mL e creatinina sérica <1,5 mg / dL.
Os sintomas de ICD geralmente ocorrem durante o uso dos antibióticos e podem começar durante a terapia com antibióticos ou até um mês após a terapia com antibióticos. A maioria dos casos ocorre dentro de duas semanas de terapia antibiótica. Raramente, os sintomas se manifestam após 10 semanas do término da antibioticoterapia. Cerca de 5 a 10 por cento dos casos não estão associados ao uso de antibióticos.
Os antibióticos mais frequentemente associados a ICD são: fluoroquinolonas, clindamicina, cefalosporinas e penicilinas, embora virtualmente qualquer antibiótico possa predispor a ICD. Fatores de risco adicionais para ICD incluem idade> 65, hospitalização recente e uso de inibidores da bomba de prótons.
O exame físico pode apresentar sensibilidade no abdome inferior. O exame de endoscopia gastrointestinal inferior (sigmoidoscopia ou colonoscopia) pode ser normal ou demonstrar alterações desde um eritema irregular leve com friabilidade até colite pseudomembranosa grave.
Leucocitose inexplicada em pacientes hospitalizados (mesmo na ausência de diarreia) pode refletir ICD subjacente. Quando a leucocitose inexplicada é causada por ICD, a diarreia geralmente se desenvolve um a dois dias depois.
Infecção por Clostridioides difficile grave e fulminante
As manifestações clínicas da colite grave incluem diarreia, dor abdominal difusa ou no quadrante inferior, distensão abdominal, febre, hipovolemia, acidose láctica, hipoalbuminemia, creatinina elevada e leucocitose acentuada (contagem de leucócitos pode chegar a 40.000 células/mL ou mais). Os critérios propostos para ICD grave incluem contagem de leucócitos > 15.000 células/mL ou creatinina sérica ≥1,5 mg/dL.
A colite fulminante é caracterizada por hipotensão ou choque, íleo ou megacólon:
● Hipotensão grave que progride para falência de órgãos pode ocorrer no quadro de ICD fulminante e/ou no quadro de perfuração intestinal com peritonite.
● Ocasionalmente, a ICD se apresenta agudamente com íleo (parada do peristaltismo intestinal), pouca ou nenhuma diarreia e acúmulo de secreções em um cólon dilatado atônico. Esses pacientes geralmente estão gravemente doentes, com dilatação do cólon (e possivelmente do intestino delgado), e geralmente com espessamento da parede do cólon, febre e leucocitose. Em alguns casos, essa apresentação parece inicialmente benigna, mas progride rapidamente.
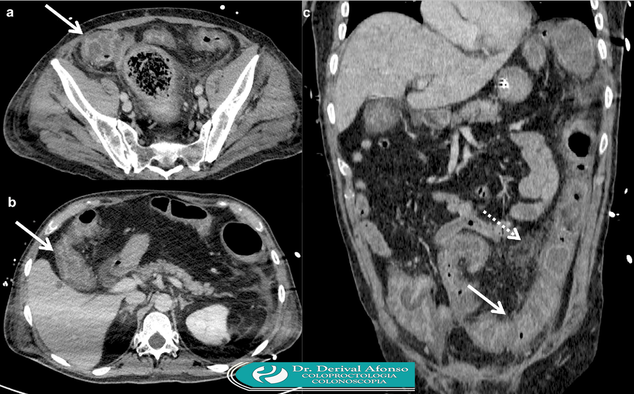
● Deve-se suspeitar de megacólon em pacientes com toxicidade sistêmica grave associado a dilatação do intestino grosso (> 7 cm de diâmetro no cólon e/ou > 12 cm de diâmetro no ceco) no exames radiográficos (de preferência tomografia computadorizada de abdome e pelve). O megacólon pode complicar com perfuração intestinal.
Infecção por Clostridioides difficile recorrente
ICD recorrente é definida pela resolução dos sintomas de ICD com o tratamento, seguida pelo reaparecimento dos sintomas dentro de duas a oito semanas após o seu término. Até 25 por cento dos pacientes recorrem dentro de 30 dias após a conclusão do tratamento. Menos comumente, a recorrência de ICD acontece entre 4 e 9 semanas após o término do tratamento. Uma vez que os pacientes apresentem recorrência, eles têm um risco significativamente maior de novas recorrências.
A doença recorrente pode ser leve, grave ou fulminante. Cerca de 34% dos pacientes com infecção recorrente precisam de internação, 28% desenvolvem doença grave e 4% desenvolvem colite fulminante.
Os fatores de risco para recorrência incluem idade > 65 anos, doenças crônicas graves, necessidade de terapia contínua com antibióticos concomitantes durante o tratamento para ICD e falta de uma resposta imune mediada por anticorpos à toxina B.
Os sintomas recorrentes podem ser devido à recidiva da cepa infectante inicial ou reinfecção com uma nova cepa. A ICD recorrente frequentemente representa recidiva, em vez de reinfecção, independentemente do intervalo entre os episódios.
A diarreia persistente durante a terapia inicial deve levar a uma avaliação para outras causas e não deve ser considerada doença recorrente. Na ausência de um diagnóstico alternativo, esses pacientes devem ser considerados como tendo ICD refratária.
Pacientes com diarreia recorrente, cólicas e distensão abdominal após o tratamento de ICD podem ter síndrome do intestino irritável pós-infecciosa ou outra colite inflamatória. Em casos atípicos, a colonoscopia deve ser considerada para avaliar a evidência de ICD e para excluir outras etiologias.
Portadores assintomáticos do Clostridioides difficile
Não se justifica a pesquisa do C. difficile em indivíduos assintomáticos e não se justifica que os portador assintomático de C. difficile recebam tratamento ou precauções de contato.
Os portadores assintomáticos de C. difficile pode chegar a 20 por cento dos adultos hospitalizados; esses pacientes eliminam C. difficile nas fezes, mas não têm diarreia ou outros sintomas clínicos. Em instituições de longa permanência, a taxa de colonização assintomática pode se aproximar de 50%. Esses indivíduos servem como reservatório de contaminação ambiental. A resposta imune do hospedeiro ao C. difficile pode desempenhar um papel na determinação do transporte assintomático.
Apresentações incomuns da Infecção por Clostridioides difficile
A enteropatia perdedora de proteínas com hipoalbuminemia é descrita em associação com ICD aguda na ausência de colite fulminante. A inflamação da parede intestinal permite o vazamento de albumina para o lúmen, causando perda colônica de albumina com síntese hepática compensatória inadequada. Como resultado, os níveis de albumina sérica podem cair abaixo de 2,0 g/dL (20 g/L). Ascite e edema periférico podem ser observados. A enteropatia perdedora de proteínas responde à terapia médica apropriada para a infecção.
•A apendicite por ICD foi descrita em alguns relatos de casos.
•O envolvimento do intestino delgado com enterite por C. difficile é raro, mas pode ocorrer em adultos mais velhos e/ou pacientes com múltiplas comorbidades.
•Casos raros de celulite por C. difficile , infecção de tecidos moles, bacteremia e artrite reativa foram descritos.
Pacientes com suspeita de infecção por C. difficile devem ser colocados em isolamento para evitar o contato e contaminação como precaução antes da avaliação diagnóstica.
O diagnóstico de ICD é realizado pela pesquisa nas fezes das toxina A e B de C. difficile ou teste de amplificação de ácido nucleico positivo (NAAT) para o gene da toxina B de C. difficile (realizado por método de PCR em tempo real). A abordagem diagnóstica para suspeita de C. difficile recorrente é a mesma.
Apenas os pacientes com diarreia devem ser investigados para ICD. Fezes formadas de pacientes assintomáticos não devem ser submetidas a testes laboratoriais, uma vez que a presença da toxina do C. difficile não distingue entre ICD e portador assintomático (que não justifica tratamento).
Para pacientes com íleo (ausência de peristaltismo) e suspeita de ICD, o diagnóstico laboratorial por meio de esfregaço retal para ensaio de toxina ou cultura anaeróbia pode ser realizado; a sensibilidade do esfregaço retal para cultura de C. difficile no contexto do íleo é alta (embora leve tempo).
Não há papel para repetir os testes laboratoriais (dentro de sete dias) durante o mesmo episódio de diarreia, e não há indicação de teste de cura. Também não há função para testes laboratoriais em pacientes assintomáticos ou em pacientes recebendo tratamento para ICD aguda; as análises de fezes podem permanecer positivas durante ou após a recuperação clínica. No entanto, para pacientes com sintomas recorrentes após a resolução inicial da diarreia, a repetição do teste é necessária para avaliar doença recorrente.
É importante saber que a toxina do C. difficile é degrada à temperatura ambiente sendo indetectável dentro de duas horas após a coleta; portanto, as amostras para teste com base na detecção de toxinas devem ser mantidas a 4ºC se houver previsão de atraso nos testes de laboratório. Além disso, um surto suspeito deve levar ao congelamento de amostras de fezes para investigação posterior.
A pesquisa de leucócitos fecais não é útil para o diagnóstico de ICD.
A tomografia computadorizada (TC) do abdômen e pelve deve ser realizada para pacientes com manifestações clínicas de doença grave (dor abdominal intensa, distensão abdominal com íleo aparente, febre, hipovolemia, acidose láctica, hipoalbuminemia e/ou leucocitose acentuada) ou colite fulminante (caracterizado por hipotensão ou íleo) para avaliar a presença de megacólon tóxico, perfuração intestinal ou outros achados que justifiquem intervenção cirúrgica.
A evidência radiográfica de dilatação do cólon (> 7 cm de diâmetro) no cenário clínico de ICD grave é diagnóstica de megacólon tóxico. Outros achados radiográficos consistentes com megacólon tóxico incluem dilatação do intestino delgado, níveis hidroaéreos (sugerem obstrução intestinal ou isquemia) e "impressão digital" (recorte da parede do intestino) devido ao edema submucoso. No cenário de perfuração intestinal, pode ser observado ar abdominal livre.
Outros achados da tomografia computadorizada (TC) associados à colite por C. difficile incluem espessamento pronunciado da parede do cólon correspondendo a edema da mucosa e submucosa (que pode ser visível como um "sinal-alvo" ou "sinal do halo duplo" consistindo em dois ou três anéis concêntricos de atenuação diferente).
Em geral, a endoscopia é realizada em circunstâncias em que se suspeite de um diagnóstico alternativo que requeira visualização direta e/ou biópsia da mucosa intestinal. Também pode ser útil para pacientes com íleo ou colite fulminante na ausência de diarreia, uma vez que pode permitir a visualização de pseudomembranas (inflamação grave do revestimento interno do intestino), um achado que é altamente sugestivo de ICD. A sigmoidoscopia flexível limitada sem preparo é preferida e realizada com insuflação mínima ou nenhuma insuflação de ar para evitar a perfuração do cólon inflamado.
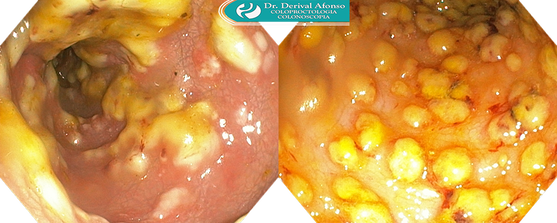
Os achados da endoscopia gastrointestinal inferior no contexto de ICD incluem edema da parede intestinal, eritema, friabilidade e inflamação. O achado de pseudomembranas na superfície da mucosa inflamada é altamente sugestivo de ICD e deve levar à confirmação laboratorial do diagnóstico, se ainda não tiver sido realizado. No entanto, nem todos os pacientes com ICD têm pseudomembranas, particularmente pacientes com infecção leve ou parcialmente tratada, e a ausência de pseudomembranas não descarta a ICD. Pseudomembranas são raramente observadas no contexto de ICD recorrente ou doença inflamatória intestinal.
As pseudomembranas são placas elevadas amarelas ou esbranquiçadas de até 2 cm de diâmetro espalhadas sobre a mucosa do cólon. Alguns pacientes com colite pseudomembranosa têm lesões descontínuas com segmentos de mucosa interpostas de aparência relativamente normal, enquanto outros têm uma pseudomembrana confluente cobrindo difusamente toda a mucosa. As pseudomembranas podem estar ausentes no retossigmóide e presentes apenas proximalmente, embora a colonoscopia para avaliação do cólon proximal não seja garantia de diagnóstico de C. difficile, dada a friabilidade do tecido intestinal e risco de perfuração.
A biópsia não é necessária para o diagnóstico de C. difficile. A biópsia pode ser necessária para estabelecer um diagnóstico alternativo, particularmente para pacientes que não estão respondendo clinicamente à terapia apropriada para ICD.
• Abdome agudo - ICD pode se apresentar com distensão abdominal simulando íleo do intestino delgado, síndrome de Ogilvie (pseudo-obstrução do cólon), volvo ou isquemia intestinal. A abordagem do diagnóstico varia de acordo com a idade, sexo e condição; as ferramentas incluem história e exame físico, consulta cirúrgica e imagem radiográfica.
• Choque - Pode ocorrer hipotensão grave no quadro de ICD fulminante e/ou no quadro de perfuração intestinal com peritonite. Além disso, a ICD pode se desenvolver durante o tratamento com antibióticos para choque séptico causado por uma infecção bacteriana separada. O choque devido a outras causas (como choque séptico ou choque cardiogênico) deve ser diferenciado de hipotensão grave devido a ICD por meio de avaliação cardíaca e hemodinâmica.
• Diarreia infecciosa - Outros organismos que podem causar diarreia associada a antibióticos incluem Staphylococcus aureus, Klebsiella oxytoca, Clostridium perfringens e Salmonella sp. As manifestações clínicas são semelhantes às da ICD; o diagnóstico é diferenciado pela cultura de fezes e exames específicos para o diagnóstico da ICD.
• Diarreia não infecciosa - Causas de diarreia não infecciosa que podem mimetizar ICD incluem síndrome do intestino irritável pós-infecciosa, doença inflamatória intestinal, doença celíaca e colite microscópica. A diferenciação entre diarreia não infecciosa associada a antibióticos e ICD pode ser difícil, especialmente em pacientes que são portadores assintomáticos de C. difficile; isso é mais relevante entre pacientes em lares de idosos ou hospitais onde a taxa de portador assintomático varia de 10 a 50 por cento (em populações comunitárias, a taxa de portador assintomático é ≤5 por cento). A cessação dos sintomas com a interrupção da ingestão oral é uma característica distintiva da diarreia osmótica de má absorção de carboidratos. A presença de febre e leucocitose favorece C. difficile ou outra etiologia infecciosa.
• Síndrome do intestino irritável pós-infeccioso - A síndrome do intestino irritável pós-infecciosa ocorre em cerca de 10 por cento dos pacientes que foram tratados com sucesso para um episódio inicial de C. difficile. Esses pacientes podem apresentar até 10 evacuações aquosas por dia; isso deve ser diferenciado de uma recaída do ICD original com base em critérios já discutidos acima.
• Doença inflamatória intestinal - A infecção por C. difficile pode complicar o curso da doença inflamatória intestinal (DII). As infecções entéricas são responsáveis por cerca de 10 por cento das recidivas sintomáticas em pacientes com DII; C. difficile é responsável por cerca de metade dessas infecções. A associação entre DII e C. difficile pode ser devido a uma variedade de fatores, incluindo disbiose associada à colite ou ao uso de antibióticos para o tratamento de outros patógenos gastrointestinais e hospitalização frequente para controle de crises de DII. Raramente, infecção C. difficile desencadeia um ataque inicial de DII.
A ICD em pacientes com DII requer diagnóstico e tratamento imediatos, uma vez que a falha no diagnóstico da infecção pode levar ao tratamento inadequado com glicocorticoides ou terapia imunossupressora. Além disso, o C. difficile pode ser difícil de distinguir de uma recidiva de DII devido aos sintomas semelhantes de diarreia, dor abdominal e febre baixa. Assim, um alto índice de suspeita é necessário ao avaliar pacientes com DII com crises aparentes, especialmente aqueles que receberam antibióticos recentemente e/ou foram hospitalizados.
O diagnóstico requer testes laboratoriais; a endoscopia geralmente não é útil porque os pacientes com DII geralmente não desenvolvem pseudomembranas. Há uma alta prevalência de portadores assintomáticos de C. difficile em pacientes com DII. A razão para esta observação não é certa; as possibilidades incluem alteração da flora microbiana do cólon, inflamação da mucosa e comprometimento da imunidade inata da mucosa.
• Colite microscópica - A colite microscópica é uma doença inflamatória crônica do cólon caracterizada por diarreia aquosa crônica. O diagnóstico é estabelecido por colonoscopia com biópsia.
• Doença celíaca - A doença celíaca é uma doença do intestino delgado associada à intolerância à exposição ao glúten na dieta; sintomas gastrointestinais, incluindo diarreia crônica ou recorrente, má absorção, perda de peso e distensão ou inchaço abdominal. O diagnóstico é feito por sorologia e / ou biópsia.
Controle da infecção por Clostridioides difficile
Pacientes com suspeita ou comprovada ICD devem ser colocados em isolamento com medidas de prevenção de contatos, e os profissionais de saúde devem lavar as mãos antes e depois do contato com o paciente. A higiene das mãos com água e sabão é mais eficaz do que a desinfecção com álcool na remoção de esporos de C. difficile, uma vez que os esporos de C. difficile são resistentes ao álcool.
Descontinuar o (s) antibiótico (s) provocadores
Um passo inicial importante no tratamento da ICD é a suspenção do (s) antibiótico (s) o mais rápido possível. O tratamento com antibióticos concomitantes (ou seja, antibióticos diferentes daqueles administrados para tratar ICD) está associado ao prolongamento da diarreia, maior probabilidade de falha do tratamento e aumento do risco de ICD recorrente. Se antibióticos contínuos são essenciais para o tratamento da infecção primária, se possível, é prudente selecionar agentes antibióticos que são menos frequentemente implicados em ICD associada a antibióticos.
Controle da hidratação, nutrição e diarreia
A correção de perdas de líquidos e desequilíbrios eletrolíticos são importantes. Os pacientes podem ter dieta regular com poucos resíduos, conforme tolerado (para reduzir a frequência e o volume das fezes). Como a diarreia é decorrente de um processo colônico, não é necessário instituir medidas como uma dieta sem lactose.
Os agentes antimotilidade (por exemplo, loperamida, difenoxilato-atropina) devem ser evitados na ICD, mas a evidência de que eles causam danos é duvidosa. Reserva-se o uso desses agentes para pacientes nos quais há dificuldade de acompanhar as perdas de fluidos, na ausência de íleo ou distensão colônica.
Os critérios propostos para a gravidade da doença (com base na opinião de especialistas) incluem:
•ICD leve a moderada - Contagem de leucócitos ≤15.000 células/mL e creatinina sérica <1,5 mg/dL.
•ICD grave - Contagem de leucócitos >15.000 células/mL e/ou creatinina sérica ≥1,5 mg/dL.
•Colite fulminante - Hipotensão ou choque, íleo ou megacólon.
Para decisões de tratamento a determinação da gravidade da doença é deixada para o julgamento do médico e pode incluir qualquer um ou todos os critérios acima. A idade ≥65 anos confere risco aumentado para ICD grave; este e outros fatores de risco são discutidos separadamente.
O tratamento não é indicado em pacientes que apresentam um exame laboratorial diagnóstico positivo, mas não apresentam diarreia ou outras manifestações de doença ICD, pois o portador assintomático é comum.
Para pacientes com um episódio inicial de ICD leve a moderada, não grave: fidaxomicina oral ou vancomicina oral são as opções de escolha.
Fidaxomicina, 200 mg por via oral duas vezes ao dia por 10 dias é a primeira opção devido ao benefício em relação às taxas de recorrência, embora pequeno. Portanto, é a primeira escolha para os pacientes com maior risco de recorrência (ou seja, idade> 65 anos, imunidade comprometida e ICD grave).
Vancomicina, 125 mg por via oral 4 vezes ao dia por 10 dias é a segunda opção. A vancomicina intravenosa não é eficaz para o tratamento de ICD, uma vez que a droga não é excretada de forma considerável no cólon quando administrada por via sistêmica.
Metronidazol, 500 mg por via oral 3 vezes ao dia por 10 a 14 dias, é um agente alternativo se a vancomicina e a fidaxomicina orais não estiverem disponíveis, mas é menos eficaz e deve ser evitado em pacientes frágeis, com idade > 65 anos, ou que desenvolvem ICD em associação com doença inflamatória intestinal. O metronidazol está associado a taxas mais altas de falha do tratamento.
Se a resposta ao tratamento demorar, isto é, for tardia, prolongá-lo por até 14 dias deve ser considerado. Se o (s) antibiótico (s) para uma infecção primária forem essenciais, alguns especialistas estendem o tratamento da infecção por C. difficile uma semana além do (s) outro (s) antibiótico (s).
Em pacientes que estão se recuperando ou cujos sintomas foram resolvidos, a repetição dos exames de fezes não necessita ser realizado durante ou após o tratamento, uma vez que até 50 por cento dos pacientes têm exames de fezes positivos por até seis semanas após a conclusão do tratamento.
O manejo da doença grave consiste em antibioticoterapia, cuidados de suporte e monitoramento rigoroso; além disso, os pacientes devem ser avaliados quanto às necessidade e indicações cirúrgicas.
Seleção dos antibióticos
Para pacientes com um episódio inicial de ICD grave, sugere-se fidaxomicina oral em vez de vancomicina oral. O metronidazol não é recomendado para ICD grave.
Em pacientes com ruptura da mucosa devido a colite grave ou fulminante, pode ocorrer absorção sistêmica de vancomicina enteral; esta consideração é particularmente importante para pacientes com insuficiência renal (clearance da creatinina <10 mL/minuto). Deve monitorar os níveis séricos de vancomicina em pacientes com insuficiência renal que têm colite grave e requerem um curso prolongado (> 10 dias) de terapia com vancomicina enteral.
A duração padrão da terapia antibiótica com vancomicina (125 mg por via oral 4 vezes ao dia) ou fidaxomicina (200 mg por via oral duas vezes ao dia) para um episódio inicial de ICD é de 10 dias; no entanto, a duração do curso de antibióticos deve ser individualizada para pacientes com doença grave, dependendo da resposta ao tratamento e do curso clínico. Pacientes com uma infecção subjacente que requer administração prolongada de antibióticos devem continuar o tratamento de ICD durante todo o curso do antibiótico, mais uma semana após seu término.
Papel do transplante fecal no tratamento da Infecção por Clostridioides difficile grave
TMF foi usado em pacientes com colite grave e fulminante como uma alternativa à colectomia e foi associado a reduções na mortalidade em estudos retrospectivos e observacionais; no entanto, estudos prospectivos randomizados comparando TMF com colectomia são necessários para determinar se há um papel para o uso rotineiro de TMF no tratamento de CDI grave e fulminante.
•Hipotensão.
•Febre ≥38,5 ° C.
•Íleo ou distensão abdominal significativa.
•Peritonite ou dor abdominal significativa.
•Estado mental alterado.
•Contagem de leucócitos ≥20.000 células/mL.
•Níveis de lactato sérico> 2,2 mmol/L.
•Admissão em unidade de terapia intensiva.
•Insuficiência do órgão final (por exemplo, requerendo ventilação mecânica, insuficiência renal).
•Falha em melhorar após três a cinco dias de terapia médica máxima.
Deve-se suspeitar de megacólon tóxico se o paciente desenvolver distensão abdominal com diminuição da diarreia; isso pode refletir íleo paralítico resultante da perda do tônus muscular do cólon.
A consulta cirúrgica precoce facilita a indicação cirúrgica oportuna se o curso clínico do paciente piorar. Vários estudos demonstraram ou sugeriram que em pacientes submetidos à cirurgia para colite por C. difficile, o tratamento cirúrgico oportuno melhora os resultados.
A abordagem para o manejo dos antibióticos de ICD recorrente é a mesma, independentemente da gravidade, mas varia dependendo do número de recorrências. Para pacientes com um episódio recorrente de ICD grave, as considerações sobre cirurgia e TMF são as discutidas acima.
Primeira recorrência da Infecção por Clostridioides difficile
Para pacientes com uma primeira recorrência de ICD, prefere-se a fidaxomicina em vez da vancomicina. Esses agentes podem ser administrados com dosagem padrão ou em um regime pulsado estendido. A justificativa para o uso de um regime pulsado é baseada na hipótese de que esta abordagem pode facilitar um retorno gradual do microbioma colônico normal e/ou permitir o tratamento de C. difficile vegetativo liberado por esporos fecais persistentes.
A duração da antibioticoterapia depende do regime selecionado. Para pacientes com ICD no contexto de outra infecção subjacente que requer uma duração prolongada de terapia antibiótica, normalmente continua-se o tratamento com ICD durante todo o curso de antibióticos mais uma cauda adicional de uma semana após o seu término.
Regimes de antibióticos:
- Fidaxomicina
- 200 mg por via oral duas vezes ao dia por 10 dias, OU
- 200 mg por via oral duas vezes ao dia por 5 dias, seguido por uma vez a cada dois dias por 20 dias
- Vancomicina 125 mg por via oral 4 vezes ao dia por 10 dias
- Vancomicina em um regime cônico e pulsado, por exemplo:
- 125 mg por via oral 4 vezes ao dia por 10 a 14 dias, então
- 125 mg por via oral 2 vezes ao dia por 7 dias, então
- 125 mg por via oral uma vez ao dia por 7 dias, então
- 125 mg por via oral a cada 2 a 3 dias por 2 a 8 semanas
O uso de bezlotoxumab (anticorpo monoclonal humanizado que se liga à toxina B de C. difficile), recebeu a aprovação do US Food and Drug Administration em 2016. O bezlotoxumabe é administrado como uma infusão única 10 mg/kg por via intravenosa, durante a administração de um regime de tratamento padrão; deve ser usado com cautela em pacientes com insuficiência cardíaca congestiva.
Segunda recorrência ou recorrência subsequente da Infecção por Clostridioides difficile
Para pacientes que receberam tratamento antibiótico apropriado para pelo menos três episódios de ICD (ou seja, episódio inicial mais duas recorrências), que subsequentemente se apresentam com um quarto ou outro episódio (terceiro ou recorrência subsequente), sugere-se o TMF nas regiões onde está disponível.
Para pacientes com uma terceira recorrência de ICD ou subsequente que não podem se submeter a TMF, o manejo consiste em terapia antibiótica (além do uso adjuvante de bezlotoxumabe). Após a conclusão de um regime de tratamento, sugere-se o uso de vancomicina oral supressiva em algumas circunstâncias.
Regimes de antibióticos:
- Fidaxomicina
- 200 mg por via oral duas vezes ao dia por 10 dias, OU
- 200 mg por via oral duas vezes ao dia por 5 dias, seguido por uma vez a cada dois dias por 20 dias
- Vancomicina em um regime cônico e pulsado (exemplo como acima)
- Vancomicina seguida por rifaximina:
- Vancomicina 125 mg por via oral 4 vezes ao dia por via oral por 10 dias, então
- Rifaximina 400 mg por via oral 3 vezes ao dia por 20 dias
Papel do transplante de microbiota fecal (TMF): Para pacientes que receberam tratamento antibiótico apropriado para pelo menos 3 episódios de ICD (ou seja, episódio inicial mais 2 recorrências), que subsequentemente se apresentam com um quarto ou mais episódio de ICD (terceira ou subsequente recorrência), prefere-se TMF em regiões onde disponível.
Transplante de microbiota fecal (TMF) no tratamento da Infecção por Clostridioides difficile
O TMF consiste na instilação de fezes processadas de doador no trato intestinal de um paciente com ICD recorrente. Evita-se o TMF em pacientes imunocomprometidos e pacientes com doença inflamatória intestinal. Os riscos associados à TMF incluem complicações do procedimento e transmissão de infecção.
A eficácia, taxas de cura, do TMF para o tratamento de ICD recorrente variam de 70 a 90 por cento dentro de um período de acompanhamento variando de 10 a 18 semanas.
Para pacientes com ICD recorrente que não são candidatos ao TMF, sugere-se o uso de vancomicina oral supressiva (125 mg por via oral uma vez ao dia) por seis a oito semanas após a conclusão do tratamento com antibióticos, mas com acompanhamento rigoroso; os pacientes com maior probabilidade de se beneficiarem são aqueles com maior risco de recorrência de ICD (por exemplo, pacientes ≥65 anos, pacientes com histórico de ICD grave ou pacientes imunossuprimidos). Alguns pacientes continuam a apresentar fezes amolecidas com esta dose; em tais casos, a dosagem duas ou três vezes ao dia é razoável. A vancomicina supressiva pode ser continuada indefinidamente para pacientes nos quais a ICD recorrente pode ser fatal.
Nos locais com restrições de custo, prioriza-se o uso de fidaxomicina e vancomicina oral supressiva para pacientes com maior risco de recorrência de ICD (por exemplo, idade ≥65 anos, história de ICD grave ou imunossupressão).
Tratamento da colite fulminante por Clostridioides difficile na ausência de íleo
Para o tratamento de pacientes com colite fulminante, mas sem íleo intestinal sugere-se vancomicina oral (ou por sonda nasogástrica) (500 mg quatro vezes ao dia) associado ao metronidazol parenteral (500 mg a cada 8 horas). Nesta situação de risco de vida associado à preocupação com a motilidade intestinal dificultando a entrega ao local da infecção, doses mais altas de vancomicina são necessárias.
O uso do metronidazol parenteral se deve a lenta passagem da vancomicina oral do estômago para o cólon. As concentrações terapêuticas de metronidazol na luz intestinal são alcançadas com metronidazol intravenoso por causa da excreção biliar e intestinal da droga.
Não se usa a fidaxomicina ou bezlotoxumabe na doença fulminante devido à falta de evidências e experiência com esses agentes nesses ambientes.
Tratamento da colite fulminante por Clostridioides difficile com íleo concomitante
Para pacientes com íleo concomitante (ou outra condição que impeça a vancomicina oral de atingir o cólon), a abordagem da antibioticoterapia é a mesma para pacientes sem íleo concomitante, conforme discutido na seção anterior.
As considerações adicionais incluem a adição da vancomicina (administrada por via retal) ou TMF (administrado via retal por enema ou anterógrado via colostomia em alça). No entanto, essas intervenções estão associadas ao risco de perfuração do cólon; portanto, eles devem ser restritos a pacientes que não respondem à terapia padrão e o procedimento deve ser realizado por pessoal com experiência adequada:
• Se o TMF estiver disponível, sugere-se seu uso por via retal ou colostomia em alça em vez de vancomicina retal, dada a maior probabilidade de benefício.
• Se a vancomicina retal for administrada, ela é administrada juntamente com a vancomicina oral (uma vez que pode ser difícil determinar se o íleo é parcial ou completo).
A dosagem ideal de vancomicina retal não está estabelecida e as descrições dos casos variam amplamente. Frequentemente, é administrado como enema de retenção (500 mg em 100 mL de solução salina; retido pelo maior tempo possível e administrado a cada seis horas).
Conforme discutido para doença grave acima, a duração da terapia é geralmente de pelo menos 10 dias, mas deve ser individualizada para o curso clínico; se a recuperação for mais demorada, a duração pode ser estendida para 14 dias.
Em pacientes com colite grave ou fulminante a ruptura da mucosa pode levar a absorção sistêmica de vancomicina enteral; esta consideração é particularmente importante para pacientes com insuficiência renal (depuração da creatinina <10 mL/minuto). Deve-se monitorar os níveis séricos de vancomicina em pacientes com insuficiência renal que têm colite grave ou fulminante e requerem um curso prolongado (>10 dias) de terapia com vancomicina enteral. A vancomicina intravenosa não tem efeito sobre a colite por C. difficile, uma vez que a vancomicina não é excretada no cólon.
A doença fulminante é suportada pelos seguintes dados clínicos: hipotensão ou choque, íleo e megacólon.
- Ausência de íleo: vancomicina entérica mais metronidazol parenteral:
- Vancomicina Δ 500 mg por via oral ou via sonda nasogástrica 4 vezes ao dia, E
- Metronidazol 500 mg por via intravenosa a cada 8 horas
- Se o íleo estiver presente, as considerações adicionais incluem:
- TMF (administrado por via retal) OU
- Vancomicina retal (administrada via retal na forma de enema de retenção 500 mg em 100 mL de solução salina; retida pelo maior tempo possível e administrada a cada 6 horas).
Papel do transplante microbiota fecal na infecção por Clostridioides difficile
As circunstâncias nas quais o TMF tem maior probabilidade de ter benéfico são incertas; os dados sobre o TMF para tratamento de ICD fulminante são limitados.
Entre os pacientes com doença fulminante, as situações em que se considera o TMF incluem:
• Pacientes com infecção recorrente fulminante.
• Pacientes com doença fulminante e íleo concomitante (ou outra condição que impeça a vancomicina oral de atingir o cólon); nesses casos, prefere-se o TMF (administrada por via retal ou por colostomia em alça), além da antibioticoterapia.
• Pacientes com doença fulminante sem melhora após três a cinco dias de tratamento.
Probióticos no tratamento da Infecção por Clostridioides difficile
Não é recomendada a administração adjuvante de probióticos no tratamento de ICD. As limitações dos dados disponíveis incluem diferenças nas formulações probióticas estudadas, duração da administração de probióticos, definições de ICD, duração do acompanhamento do estudo e inclusão de pacientes normalmente não considerados de alto risco para ICD.
• Minimizar o uso de antibióticos.
• Evitar a supressão de ácido gástrico.
A profilaxia primária com vancomicina oral pode ser benéfica em pacientes com alto risco de ICD. Pacientes hospitalizados com alto risco de um primeiro episódio de ICD (idade ≥60 anos que receberam antibióticos sistêmicos durante uma hospitalização anterior dentro de 30 dias e estavam recebendo antibióticos durante a hospitalização atual), a vancomicina (125 mg por dia) reduz a taxa de ICD durante a hospitalização em comparação com nenhuma profilaxia.
A vacinação é uma área de investigação para a prevenção de ICD. Vários estudos demonstraram que a resposta imune humoral do hospedeiro às toxinas A e B de C. difficile influencia o curso clínico da ICD, bem como o risco de recaída.
Existem estudos com vários probióticos para a prevenção de ICD; os dados são altamente inconsistentes. Nenhum agente probiótico isolado mostrou eficácia confiável ou reproduzível para a prevenção de ICD (mesmo Saccharaomyces boulardii ou Lactobacillus GG, que são os mais bem estudados).
Prevenção secundária - As estratégias para prevenir um episódio recorrente de ICD incluem aquelas resumidas acima para prevenir um episódio inicial de ICD. Estratégias adicionais incluem:
• Uso de profilaxia secundária durante o uso concomitante de antibióticos - Para pacientes com risco aumentado de recorrência (pacientes ≥65 anos de idade ou pacientes imunocomprometidos que foram hospitalizados por ICD grave nos últimos três meses) que requerem tratamento contínuo com antibióticos sistêmicos, recomenda-se a vancomicina oral (125 mg por via oral uma vez ao dia) durante o tratamento com antibióticos prolongando-a por mais uma semana após a interrupção do antibiótico. O metronidazol não deve ser usado para profilaxia secundária devido à sua associação dose dependente com neuropatia periférica. Os dados sobre o uso de fidaxomicina na profilaxia secundária ainda não estão disponíveis.
• Colonização gastrointestinal por cepas não-toxigênicas de C. difficile - A colonização gastrointestinal por cepas não-toxigênicas de C. difficile tem demonstrado prevenir ICD com exposição a uma cepa toxigênica; é necessário um estudo mais aprofundado desta abordagem.
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.