Posicionamento sobre a vacinação para SARS-CoV2 em pacientes com DI
Iniciativa do GEDIIB através do comitê Covid-19
https://gediib.org.br/noticias/posicionamento-sobre-a-vacinacao-para-sars-cov2-em-pacientes-com-dii/
A pandemia de COVID-19 é uma emergência de saúde pública de interesse internacional e o Brasil é atualmente uma das regiões mais atingidas, tendo uma das maiores taxas de mortalidade de COVID-19 do mundo [1]. A vacinação em massa oferece a melhor estratégia para enfrentamento da pandemia de COVID-19, e as vacinas contra SARS-CoV2 estão sendo aprovadas em vários países para uso emergencial. No Brasil, foram aprovadas para uso emergencial as vacinas Oxford/AstraZeneca e Sinovac SARS-CoV-2 no último dia 17/01/2021, no entanto, existem potenciais preocupações em relação às recomendações de vacinas para populações específicas, como pacientes com doença inflamatória intestinal (DII). Para responder a essas questões, o Grupo Brasileiro de Estudos IBD (GEDIIB) fornece conselhos práticos com recomendações importantes sobre as vacinas para COVID-19 na população com DII.
https://gediib.org.br/noticias/posicionamento-sobre-a-vacinacao-para-sars-cov2-em-pacientes-com-dii/
A pandemia de COVID-19 é uma emergência de saúde pública de interesse internacional e o Brasil é atualmente uma das regiões mais atingidas, tendo uma das maiores taxas de mortalidade de COVID-19 do mundo [1]. A vacinação em massa oferece a melhor estratégia para enfrentamento da pandemia de COVID-19, e as vacinas contra SARS-CoV2 estão sendo aprovadas em vários países para uso emergencial. No Brasil, foram aprovadas para uso emergencial as vacinas Oxford/AstraZeneca e Sinovac SARS-CoV-2 no último dia 17/01/2021, no entanto, existem potenciais preocupações em relação às recomendações de vacinas para populações específicas, como pacientes com doença inflamatória intestinal (DII). Para responder a essas questões, o Grupo Brasileiro de Estudos IBD (GEDIIB) fornece conselhos práticos com recomendações importantes sobre as vacinas para COVID-19 na população com DII.
I. Os pacientes com DII devem ser priorizados nos grupos de distribuição de vacinação?
Os pacientes com DII geralmente requerem tratamento com medicamentos imunossupressores, que podem aumentar o risco de infecções. No entanto, dados recentes sugerem que eles não têm um risco aumentado de infecção de SARS-CoV2 ou de desenvolvimento de complicações COVID-19 [2]. Portanto, é improvável que um paciente com DII se qualifique para um grupo prioritário de vacinação com base isoladamente no diagnóstico de DII. A priorização deve ocorrer com base na idade e comorbidades associadas.
II. Quais vacinas estão disponíveis atualmente?
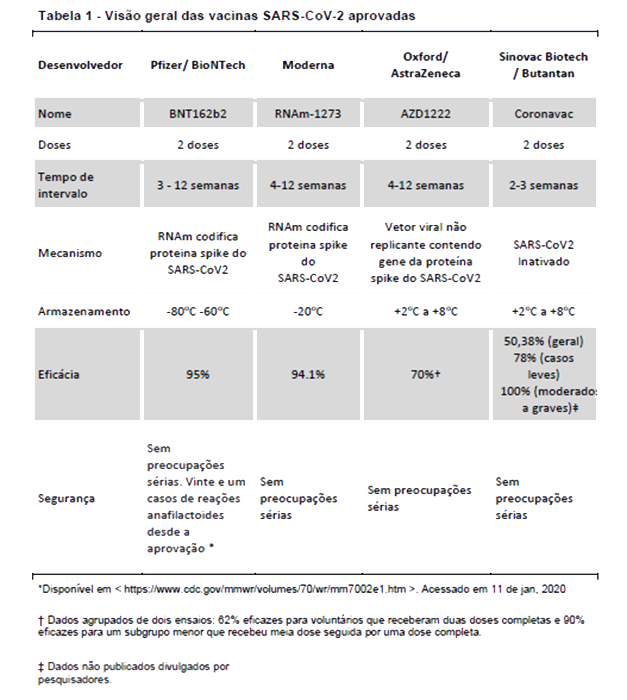
A Anvisa aprovou o uso emergencial para as vacinas Oxford/AstraZeneca e Sinovac SARS-CoV-2 no último dia 17/01/2021. A Tabela 1 fornece uma visão geral das vacinas para SARS-CoV2.
Os pacientes com DII geralmente requerem tratamento com medicamentos imunossupressores, que podem aumentar o risco de infecções. No entanto, dados recentes sugerem que eles não têm um risco aumentado de infecção de SARS-CoV2 ou de desenvolvimento de complicações COVID-19 [2]. Portanto, é improvável que um paciente com DII se qualifique para um grupo prioritário de vacinação com base isoladamente no diagnóstico de DII. A priorização deve ocorrer com base na idade e comorbidades associadas.
II. Quais vacinas estão disponíveis atualmente?
A Anvisa aprovou o uso emergencial para as vacinas Oxford/AstraZeneca e Sinovac SARS-CoV-2 no último dia 17/01/2021. A Tabela 1 fornece uma visão geral das vacinas para SARS-CoV2.
III. A imunossupressão afeta a eficácia da vacina COVID-19?
Para outras vacinas comuns, foi demonstrado que medicamentos imunossupressores podem resultar em alguma redução na formação de anticorpos e menor resposta vacinal. Por exemplo, foi demonstrado que a resposta imune à vacinação pneumocócica polissacarídica (PSV-23) é prejudicada em pacientes com doença de Crohn (CD) em terapia combinada de biológicos anti-TNF e imunomoduladores [3], também é afetada a taxa de conversão sorológica para vacina contra influenza em pacientes imunossuprimidos com DII [4,5]. Por outro lado, o tratamento com ustequinumabe ou vedolizumabe não parecem reduzir as respostas à vacina contra a gripe [6,7]. Não sabemos se as vacinas disponíveis serão tão eficazes em pacientes com DII, visto que a maioria dos ensaios de vacinas excluiu os pacientes com este diagnóstico. Levando em consideração o maior nível de eficácia das vacinas disponíveis contra COVID-19 sintomático e COVID-19 grave (70% -95%), muito melhor do que a vacina contra gripe (50%-60%), prevê-se que a vacina para SARS COV-2 proteja em taxas mais altas, mesmo que o tratamento com agentes imunossupressores possa interferir na resposta.
IV. Há alguma preocupação de segurança em relação à vacinação contra SARS-Cov-2 em pacientes com DII?
Não há evidências que sugiram um risco aumentado da vacina contra SARS-CoV-2 em pacientes com DII. Embora seja possível que outras vacinas estejam disponíveis em breve, é importante ressaltar que, para as listadas na Tabela 1, a imunossupressão não é uma contra-indicação. Além disso, as vacinas SARS-CoV2 foram testadas em dezenas de milhares de pacientes com perfis de segurança muito semelhantes a outras vacinas comumente usadas em pacientes com DII, como a vacina contra a gripe. Além disso, os pacientes com DII foram vacinados com vacinas contra influenza e pneumonia por muitos anos, sem indicação de agravamento dos sintomas de DII ou exacerbações após a vacinação [4]. Assim, semelhante a outras vacinas usadas por muitos anos, a imunização parece muito improvável de afetar a atividade da DII.
V. Os pacientes com DII devem adiar o tratamento biológico ou suspender a imunossupressão para serem vacinados?
Recomendamos que a vacina COVID-19 seja administrada a qualquer momento, independentemente da última infusão biológica/dose subcutânea recebida, pois não é uma vacina viva. A única recomendação a esse respeito é que os pacientes devem evitar receber sua vacina no mesmo dia da infusão/dose subcutânea, pois, caso o paciente desenvolva uma reação ou evento adverso, fica difícil identificar qual agente (vacina ou biológico) causou a reação.
Portanto, à luz das evidências atuais, apoiamos fortemente a recomendação de vacinar todos os pacientes com DII contra a SARS-CoV2, independentemente do seu tratamento atual. Para situações específicas não discutidas neste documento, recomendamos que a decisão de vacinar ou não seja tomada individualmente, a partir de uma decisão compartilhada com os pacientes.
Esta revisão representa a opinião de um grupo de especialistas. Está de acordo com as evidências disponíveis e o posicionamento dos principais grupos internacionais de especialistas em DII. Outras vacinas aprovadas e novos dados podem estar disponíveis em poucas semanas. Portanto, esta recomendação pode mudar e será revisada periodicamente.
Fonte: Este manuscrito foi aceito para publicação em 18/01/2021 na revista Arquivos de Gastroenterologia no número 1 de 2021, ahead of print.
Referências
1. Dong E, Du H, Gardner L. An interactive web-based dashboard to track COVID-19 in real time. Lancet Infect Dis 2020;20(5):533–4.
2. Brenner EJ, Ungaro RC, Gearry RB, Kaplan GG, Kissous-Hunt M, Lewis JD, et al. Corticosteroids, but not TNF Antagonists, are Associated with Adverse COVID-19 Outcomes in Patients With Inflammatory Bowel Diseases: Results from an International Registry. Gastroenterology 2020.
3. Melmed GY, Agarwal N, Frenck RW, Ippoliti AF, Ibanez P, Papadakis KA, et al. Immunosuppression impairs response to pneumococcal polysaccharide vaccination in patients with inflammatory bowel disease. Am J Gastroenterol 2010;105(1):148–54.
4. Mamula P, Markowitz JE, Piccoli DA, Klimov A, Cohen L, Baldassano RN. Immune response to influenza vaccine in pediatric patients with inflammatory bowel disease. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc 2007;5(7):851–6.
5. Cullen G, Bader C, Korzenik JR, Sands BE. Serological response to the 2009 H1N1 influenza vaccination in patients with inflammatory bowel disease. Gut 2012;61(3):385–91.
6. Caldera F, Hillman L, Saha S, Wald A, Grimes I, Zhang Y, et al. Immunogenicity of High Dose Influenza Vaccine for Patients with Inflammatory Bowel Disease on Anti-TNF Monotherapy: A Randomized Clinical Trial. Inflamm Bowel Dis 2020;26(4):593–602.
7. Doornekamp L, Goetgebuer RL, Schmitz KS, Goeijenbier M, van der Woude CJ, Fouchier R, et al. High Immunogenicity to Influenza Vaccination in Crohn’s Disease Patients Treated with Ustekinumab. Vaccines 2020;8(3).
Para outras vacinas comuns, foi demonstrado que medicamentos imunossupressores podem resultar em alguma redução na formação de anticorpos e menor resposta vacinal. Por exemplo, foi demonstrado que a resposta imune à vacinação pneumocócica polissacarídica (PSV-23) é prejudicada em pacientes com doença de Crohn (CD) em terapia combinada de biológicos anti-TNF e imunomoduladores [3], também é afetada a taxa de conversão sorológica para vacina contra influenza em pacientes imunossuprimidos com DII [4,5]. Por outro lado, o tratamento com ustequinumabe ou vedolizumabe não parecem reduzir as respostas à vacina contra a gripe [6,7]. Não sabemos se as vacinas disponíveis serão tão eficazes em pacientes com DII, visto que a maioria dos ensaios de vacinas excluiu os pacientes com este diagnóstico. Levando em consideração o maior nível de eficácia das vacinas disponíveis contra COVID-19 sintomático e COVID-19 grave (70% -95%), muito melhor do que a vacina contra gripe (50%-60%), prevê-se que a vacina para SARS COV-2 proteja em taxas mais altas, mesmo que o tratamento com agentes imunossupressores possa interferir na resposta.
IV. Há alguma preocupação de segurança em relação à vacinação contra SARS-Cov-2 em pacientes com DII?
Não há evidências que sugiram um risco aumentado da vacina contra SARS-CoV-2 em pacientes com DII. Embora seja possível que outras vacinas estejam disponíveis em breve, é importante ressaltar que, para as listadas na Tabela 1, a imunossupressão não é uma contra-indicação. Além disso, as vacinas SARS-CoV2 foram testadas em dezenas de milhares de pacientes com perfis de segurança muito semelhantes a outras vacinas comumente usadas em pacientes com DII, como a vacina contra a gripe. Além disso, os pacientes com DII foram vacinados com vacinas contra influenza e pneumonia por muitos anos, sem indicação de agravamento dos sintomas de DII ou exacerbações após a vacinação [4]. Assim, semelhante a outras vacinas usadas por muitos anos, a imunização parece muito improvável de afetar a atividade da DII.
V. Os pacientes com DII devem adiar o tratamento biológico ou suspender a imunossupressão para serem vacinados?
Recomendamos que a vacina COVID-19 seja administrada a qualquer momento, independentemente da última infusão biológica/dose subcutânea recebida, pois não é uma vacina viva. A única recomendação a esse respeito é que os pacientes devem evitar receber sua vacina no mesmo dia da infusão/dose subcutânea, pois, caso o paciente desenvolva uma reação ou evento adverso, fica difícil identificar qual agente (vacina ou biológico) causou a reação.
Portanto, à luz das evidências atuais, apoiamos fortemente a recomendação de vacinar todos os pacientes com DII contra a SARS-CoV2, independentemente do seu tratamento atual. Para situações específicas não discutidas neste documento, recomendamos que a decisão de vacinar ou não seja tomada individualmente, a partir de uma decisão compartilhada com os pacientes.
Esta revisão representa a opinião de um grupo de especialistas. Está de acordo com as evidências disponíveis e o posicionamento dos principais grupos internacionais de especialistas em DII. Outras vacinas aprovadas e novos dados podem estar disponíveis em poucas semanas. Portanto, esta recomendação pode mudar e será revisada periodicamente.
Fonte: Este manuscrito foi aceito para publicação em 18/01/2021 na revista Arquivos de Gastroenterologia no número 1 de 2021, ahead of print.
Referências
1. Dong E, Du H, Gardner L. An interactive web-based dashboard to track COVID-19 in real time. Lancet Infect Dis 2020;20(5):533–4.
2. Brenner EJ, Ungaro RC, Gearry RB, Kaplan GG, Kissous-Hunt M, Lewis JD, et al. Corticosteroids, but not TNF Antagonists, are Associated with Adverse COVID-19 Outcomes in Patients With Inflammatory Bowel Diseases: Results from an International Registry. Gastroenterology 2020.
3. Melmed GY, Agarwal N, Frenck RW, Ippoliti AF, Ibanez P, Papadakis KA, et al. Immunosuppression impairs response to pneumococcal polysaccharide vaccination in patients with inflammatory bowel disease. Am J Gastroenterol 2010;105(1):148–54.
4. Mamula P, Markowitz JE, Piccoli DA, Klimov A, Cohen L, Baldassano RN. Immune response to influenza vaccine in pediatric patients with inflammatory bowel disease. Clin Gastroenterol Hepatol Off Clin Pract J Am Gastroenterol Assoc 2007;5(7):851–6.
5. Cullen G, Bader C, Korzenik JR, Sands BE. Serological response to the 2009 H1N1 influenza vaccination in patients with inflammatory bowel disease. Gut 2012;61(3):385–91.
6. Caldera F, Hillman L, Saha S, Wald A, Grimes I, Zhang Y, et al. Immunogenicity of High Dose Influenza Vaccine for Patients with Inflammatory Bowel Disease on Anti-TNF Monotherapy: A Randomized Clinical Trial. Inflamm Bowel Dis 2020;26(4):593–602.
7. Doornekamp L, Goetgebuer RL, Schmitz KS, Goeijenbier M, van der Woude CJ, Fouchier R, et al. High Immunogenicity to Influenza Vaccination in Crohn’s Disease Patients Treated with Ustekinumab. Vaccines 2020;8(3).