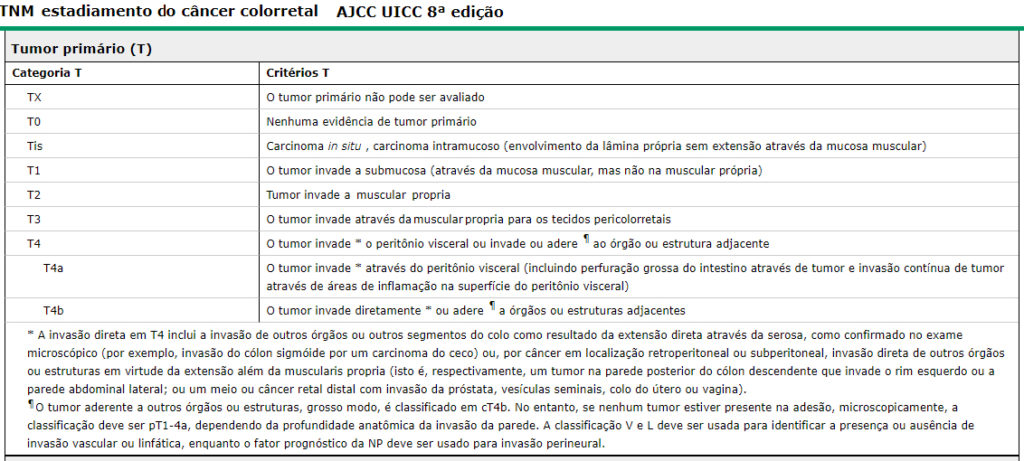
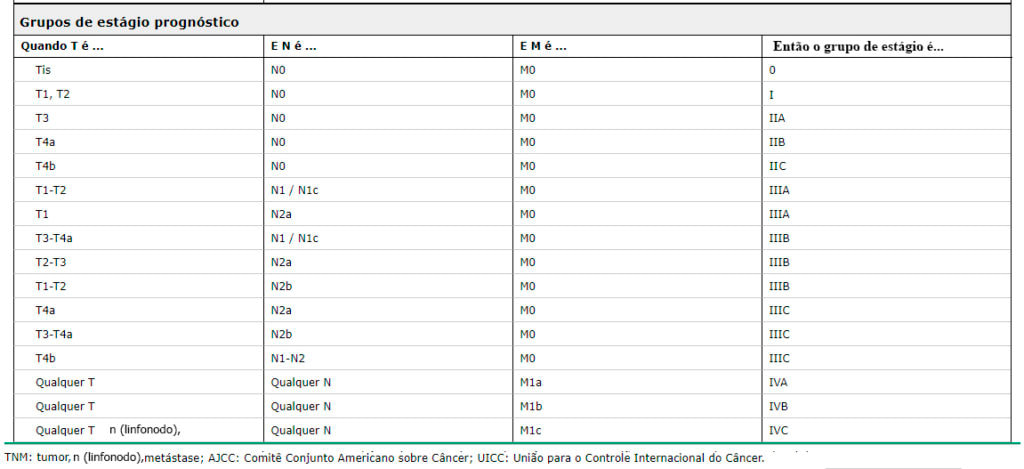
GRUPOS DE RISCOS PARA O CÂNCER COLORRETAL |
|
O termo "risco" é usado para definir a chance de uma pessoa sadia, exposta a determinados fatores, ambientais ou hereditários, desenvolver uma doença. Os fatores associados ao aumento do risco de se desenvolver uma doença são chamados fatores de risco.
A- Idade igual ou maior a 50 anos. Recentemente, a American Cancer Society (ACS) publicou novas diretrizes para abordagem da doença e anunciou que o rastreamento do câncer colorretal deve começar aos 45 anos para adultos com risco médio. Veja a revisão aqui!
História familiar de câncer colorretal, adenoma e pólipo serrilhado em seus parentes de primeiro grau (pais, filhos e irmãos).
Idade igual ou maior a 50 anos. Recentemente, a American Cancer Society (ACS) publicou novas diretrizes para abordagem da doença e anunciou que o rastreamento do câncer colorretal deve começar aos 45 anos para adultos com risco médio.
VEJA A REVISÃO AQUI!
VEJA A REVISÃO AQUI!
Recomendação para o rastreamento - Primeira colonoscopia aos 50 anos ou aos 45 anos. Se normal repetir em 5 a 10 anos.
Sensibilidade (probabilidade do portador do câncer colorretal ter o seu teste positivo), especificidade (probabilidade do indivíduo normal ter o seu teste negativo) e mortes por câncer colorretal evitadas, quando se usa a colonoscopia como rastreamento:
Sensibilidade (%) é a probabilidade do pólipo ou câncer presente ser achado.
Sensibilidade (%) é a probabilidade do pólipo ou câncer presente ser achado.
- Adenomas 1 a 5 mm - 75%
- Adenomas 6 a 9 mm - 85%
- Adenomas ≥ 10 mm - 95%
- Câncer Colorretal - 95%
Mortes por câncer colorretal evitadas por 1.000 pacientes - 22 a 24. Desde que o rastreamento entre 50 e 75 anos, com 100% de adesão, acompanhamento completo na data recomendada (5 a 10 anos), preparo de cólon ideal e examinador experiente.
Entre os exames de prevenção, a colonoscopia é o melhor para descobrir pólipos e câncer de intestino. Quando remove os pólipos preveni o câncer de intestino evitando que cresçam e se transformem em câncer. Quando uma colonoscopia de prevenção adequada é realizada, a pesquisa de sangue oculto nas fezes entre exames de colonoscopia é desnecessário.
A prevenção para pessoas de risco médio é recomendada, pela maioria das diretrizes, até os 80 anos em média. A partir dos 80 anos o seguimento dependerá do resultado da última colonoscopia e da expectativa de vida, maior que 10 anos. Se deve ao aumento da frequência do câncer de intestino com a idade e o tempo de progressão do pólipo para o câncer ser em média de 10 anos. Para os maiores de 80 anos que nunca fizeram a prevenção, uma única colonoscopia parece ser custo efetiva quando a expectativa de vida for maior que 10 anos.
História familiar de câncer colorretal, pólipo do tipo adenoma e pólipo serrilhado em seus parentes de primeiro grau (pais, filhos e irmãos).
História familiar de câncer de intestino esporádico
Risco do câncer de intestino associado a história familiar (relação da probabilidade do evento ocorrer no grupo exposto contra o grupo de controle não exposto)
- 1,0 – Sem história familiar de câncer colorretal.
- 1,82 – Parentes distantes ou parente de 1º com câncer colorretal com mais de 60 anos.
- 2,25 – Parente de 1º grau com câncer colorretal.
- 3,87 – Parente de 1º grau com menos de 45 anos câncer colorretal.
- 4,25 – Mais de um parente de 1º grau com câncer colorretal.
História familiar de pólipos (adenoma ou serrilhado)
Ter um parente de 1º grau com pólipo (adenoma ou serrilhado) no cólon aumenta o risco de adenoma e de câncer colorretal do paciente. O risco relativo é de 1,99 de câncer colorretal quando o paciente tem um parente de 1º grau com adenoma.
Dados indicam que a história familiar de um adenoma avançado (adenoma ≥ 10 mm, displasia de alto grau, 3 ou mais adenomas, adenoma com elementos vilosos) aumenta o risco de câncer colorretal, independentemente da idade no diagnóstico do familiar, a semelhança do câncer colorretal.
No caso do pólipo serrilhado avançado (≥ 10 mm, presença de displasia ou adenoma tradicional serrilhado ≥ 10 mm), o rastreamento deve ser semelhante ao de um paciente cujo parente de 1º grau documentou adenoma avançado.
As pessoas muitas vezes não sabem que tipo de pólipo seu parente teve, o que é consistente com a constatação de que muitos não sabem que tipo de pólipo eles tiveram.
As pessoas muitas vezes não sabem que tipo de pólipo seu parente teve, o que é consistente com a constatação de que muitos não sabem que tipo de pólipo eles tiveram.
Quando avaliar a história familiar do paciente na consulta?
A avaliação da história familiar para o câncer ou pólipo colorretal entre os parentes de 1º grau deve ser realizada na primeira consulta.
A história da família evolui com o tempo; assim, a avaliação da história familiar deve ser repetida à medida que o paciente envelhece, sugere-se a cada três a cinco anos, desde que o paciente seja elegível para o rastreamento contínuo com base em sua idade e doenças associadas.
Os membros da família podem desenvolver cânceres que afetam a frequência sugerida de rastreamento para o paciente. A avaliação da história familiar identifica os pacientes que necessitam do rastreamento mais cedo do que a idade inicial usual para pacientes de risco médio (45 ou 50 anos), e aqueles que também necessitam fazer o teste genético (síndromes genéticas). Portanto, as informações obtidas durante a história familiar são usadas para orientar a idade de iniciar a prevenção com a colonoscopia e a sua frequência.
A avaliação da história familiar permite determinar o número de parentes de 1º grau diagnosticados com QUALQUER uma das seguintes alterações:
1- Câncer colorretal;
2- Pólipo avançado;
---a- Adenoma avançado: adenoma ≥1 cm; adenoma com displasia de alto grau; adenoma com componente viloso;
---b- Lesão serrilhada avançada: pólipo serrilhado séssil ≥1 cm; adenoma tradicional serrilhado ≥1 cm; pólipo serrilhado séssil com displasia.
1- Câncer colorretal;
2- Pólipo avançado;
---a- Adenoma avançado: adenoma ≥1 cm; adenoma com displasia de alto grau; adenoma com componente viloso;
---b- Lesão serrilhada avançada: pólipo serrilhado séssil ≥1 cm; adenoma tradicional serrilhado ≥1 cm; pólipo serrilhado séssil com displasia.
Recomendações para fazer a prevenção do câncer de intestino
- Um parente de 1º grau diagnosticado com câncer de intestino com idade <60 anos. Comece a prevenção aos 40 anos de idade, ou 10 anos antes do diagnóstico do parente de 1º grau, o que ocorrer primeiro. Sugiro colonoscopia a cada cinco anos. Se o paciente declinar da colonoscopia, a pesquisa de sangue oculto nas fezes anual deve ser oferecida.
- Dois ou mais parentes de 1º grau diagnosticados com câncer de intestino em qualquer idade. Comece a prevenção aos 40 anos de idade, ou 10 anos antes do diagnóstico mais jovem de parente de 1º grau, o que ocorrer primeiro. Sugiro colonoscopia a cada cinco anos. Se o paciente declinar a colonoscopia, a pesquisa de sangue oculto nas fezes anual deve ser oferecida.
- Um parente de 1º grau diagnosticado com câncer de intestino na idade ≥60 anos. Comece a triagem aos 40 anos de idade, usando as mesmas opções de triagem que para pacientes de risco médio, na mesma frequência que para pacientes de risco médio.
Se a única história familiar é um parente de 1º grau com um pólipo NÃO documentado claramente como um adenoma ou lesão serrilhada avançada, sugiro que seja examinado como tivesse um adenoma ou lesão serrilhada avançada, devido à imprecisão potencial do histórico familiar.
Existem evidências de que a colonoscopia para rastreamento deve ser repetida em intervalos de cinco anos, no máximo, para as pessoas com história familiar de câncer colorretal, adenoma ou lesão serrilhada avançados.
Quando interromper o rastreamento?
Embora não exista evidências diretas para orientar o encerramento do rastreamento do câncer colorretal para as pessoas com história familiar. As diretrizes sugerem que o rastreamento do câncer colorretal deve terminar aos 80 anos entre pessoas com um parente de 1º grau diagnosticado após os 50 anos e terminar aos 85 anos para pessoas com dois ou mais parentes de 1º grau diagnosticados antes dos 40 anos de idade, a menos que o paciente tenha uma expectativa de vida menor que 10 anos.
A continuação da triagem até os 80 ou 85 anos é razoável, pois o risco absoluto de câncer colorretal atribuível ao histórico familiar aumenta com a idade, uma vez que o risco é cumulativo. Por exemplo, o risco de uma pessoa com 70 anos de idade desenvolver câncer colorretal nos próximos 10 anos é de cerca de 9% se essa pessoa tiver pelo menos dois parentes de 1º grau com câncer colorretal, em comparação com 3% na população geral.
Pólipo serrilhado
A- Pólipos hiperplásicos
Vigilância
Em pacientes com pólipos hiperplásicos pequenos (<10 mm) confinados ao reto ou sigmóide, a colonoscopia de vigilância ou seguimento é recomendada em 5 a 10 anos, igual aos pacientes de risco médio.
Em pacientes com pólipos hiperplásicos pequenos (<10 mm) confinados ao reto ou sigmóide, a colonoscopia de vigilância ou seguimento é recomendada em 5 a 10 anos, igual aos pacientes de risco médio.
B- Pólipos serrilhados sésseis e serrilhados tradicionais
Vigilância
O intervalo de vigilância é baseado no tamanho e na histologia dos pólipos.
- Indivíduos com adenoma serrilhado séssil ou pediculado <10 mm de tamanho sem displasia são tratados como adenomas de baixo risco com uma primeira colonoscopia de vigilância em cinco anos.
- Indivíduos com adenoma serrilhado séssil ou pediculado ≥ 10 mm, com displasia ou adenoma serrilhado tradicional são tratados como adenomas de alto risco com uma primeira colonoscopia de vigilância em três anos.
- Outras recomendações de consenso sugeriram um acompanhamento colonoscópico mais precoce (intervalo de um a três anos) em indivíduos com dois ou mais adenomas serrilhado séssil ou pediculado ≥ 10 mm e naqueles com qualquer displasia.
C- Síndrome da polipose serrilhada
O diagnóstico clínico de síndrome da polipose serrilhada requer a presença de um ou mais dos seguintes critérios da Organização Mundial da Saúde:
- Pelo menos cinco pólipos serrilhados proximais ao cólon sigmóide, dos quais dois ou mais são ≥10 mm.
- Qualquer número de pólipos serrilhados proximais ao cólon sigmóide em um indivíduo que tenha um parente de primeiro grau com síndrome da polipose serrilhada.
- Mais de 20 pólipos serrilhados de qualquer tamanho, distribuídos por todo o cólon.
Vigilância
Estratégias de rastreamento para pacientes com síndrome da polipose serrilhada e sua família não estão bem definidas.
Pólipos ≥ 1 cm devem ser ressecados completamente.
Os intervalos subsequentes da colonoscopia são baseados no número e tamanho dos pólipos, bem como no número de adenomas concomitantes, mas geralmente devem ser realizados entre um e três anos.
Pólipos ≥ 1 cm devem ser ressecados completamente.
Os intervalos subsequentes da colonoscopia são baseados no número e tamanho dos pólipos, bem como no número de adenomas concomitantes, mas geralmente devem ser realizados entre um e três anos.
Indicações para colectomia (cirurgia do cólon)
- Câncer colorretal documentado ou suspeito.
- Pólipos com displasia de alto grau ou múltiplos adenomas maiores que 6 mm.
- Aumentos no número de pólipos em exames consecutivos.
- Incapacidade de examinar adequadamente o cólon por causa de múltiplos pólipos diminutivos.
- Preferência do paciente para evitar a vigilância por colono
Recomendações
Na ausência de evidências para orientar as recomendações do rastreamento para o câncer colorretal para os membros da família da síndrome da polipose serrilhada, sugiro o rastreamento de parentes de primeiro grau de indivíduos com síndrome da polipose serrilhada por volta dos 40 anos (ou 10 anos antes da idade mais precoce na apresentação da síndrome da polipose serrilhada na família). A vigilância subsequente é a cada cinco anos se nenhum pólipo for achado.
Pólipo adenomatoso (Adenoma)
Os pólipos colorretais adenomatosos são encontrados em cerca de 25% das pessoas até a idade de 50 anos; a prevalência continua a aumentar com o aumento da idade.
Avaliação do risco para câncer colorretal subsequente
A avaliação do risco para a pessoa desenvolver câncer colorretal é importante para orientar a vigilância.
Histologia, número e tamanho do adenoma são fatores de risco para adenoma e câncer metacrônico (por exemplo, diagnosticado seis meses ou mais após a remoção de um câncer ou adenoma).
Histologia, número e tamanho do adenoma são fatores de risco para adenoma e câncer metacrônico (por exemplo, diagnosticado seis meses ou mais após a remoção de um câncer ou adenoma).
Em um acompanhamento médio de aproximadamente 13 anos, as taxas de ocorrência de câncer colorretal em indivíduos com adenoma avançado, adenoma não avançado e ausência de adenoma na colonoscopia basal foram de 20, 9 e 7 por 10.000 pessoas ao ano, respectivamente.
➽Histologia
Pólipos adenomatosos com mais de 25% de componente viloso, displasia de alto grau ou câncer invasivo são fatores de risco para o desenvolvimento de câncer colorretal no futuro. Em alguns estudos, a vilosidade também prediz adenomas avançados no futuro.
Pólipos adenomatosos com mais de 25% de componente viloso, displasia de alto grau ou câncer invasivo são fatores de risco para o desenvolvimento de câncer colorretal no futuro. Em alguns estudos, a vilosidade também prediz adenomas avançados no futuro.
➽Número de pólipos
O número de adenomas na colonoscopia e cumulativamente ao longo da vida é o fator de risco mais consistente para o câncer colorretal no futuro. Estudos sugerem que pessoas com um ou dois pólipos adenomatosos pequenos e tubulares apresentam um risco pouco aumentado de câncer colorretal no futuro. Em contraste, a presença 3 ou mais adenomas de qualquer tamanho, prediz uma taxa maior de adenomas avançados e câncer no futuro. O risco é tanto maior quanto maior o número de adenomas encontrados.
O número de adenomas na colonoscopia e cumulativamente ao longo da vida é o fator de risco mais consistente para o câncer colorretal no futuro. Estudos sugerem que pessoas com um ou dois pólipos adenomatosos pequenos e tubulares apresentam um risco pouco aumentado de câncer colorretal no futuro. Em contraste, a presença 3 ou mais adenomas de qualquer tamanho, prediz uma taxa maior de adenomas avançados e câncer no futuro. O risco é tanto maior quanto maior o número de adenomas encontrados.
➽Tamanho do pólipo
Pacientes com um ou mais adenomas ≥ 10 mm têm um risco aumentado de câncer no futuro em comparação com aqueles sem neoplasia ou com um ou dois adenomas ≤ 10 mm. O risco de neoplasia avançada aumenta com o tamanho do adenoma. Em comparação com pacientes com adenomas <5 mm, aqueles com adenomas de base de 10 a 19 mm e ≥ 20 mm têm um risco significativamente maior de câncer no futuro (8, 16 e 19 por cento, respectivamente).
Pacientes com um ou mais adenomas ≥ 10 mm têm um risco aumentado de câncer no futuro em comparação com aqueles sem neoplasia ou com um ou dois adenomas ≤ 10 mm. O risco de neoplasia avançada aumenta com o tamanho do adenoma. Em comparação com pacientes com adenomas <5 mm, aqueles com adenomas de base de 10 a 19 mm e ≥ 20 mm têm um risco significativamente maior de câncer no futuro (8, 16 e 19 por cento, respectivamente).
Adenomas de baixo risco
Adenomas de baixo risco são definidos como um a dois adenomas tubulares <10 mm.
A primeira colonoscopia de vigilância deve ser realizada em 3 a 10 anos. O momento da colonoscopia de vigilância subsequente é baseado nos achados da primeira colonoscopia de vigilância.
A primeira colonoscopia de vigilância deve ser realizada em 3 a 10 anos. O momento da colonoscopia de vigilância subsequente é baseado nos achados da primeira colonoscopia de vigilância.
- Se não forem encontrados adenomas na primeira colonoscopia de vigilância, a próxima colonoscopia de vigilância é recomendada em 5 a 10 anos, mas somente se não existir outros fatores associados ao aumento do risco do câncer colorretal (por exemplo, câncer colorretal ou adenomas de alto risco em um parente de primeiro grau antes dos 60 anos de idade ou em dois parentes de primeiro grau, independentemente da idade)
- Se um adenoma de baixo risco for detectado, a próxima colonoscopia de vigilância deve ser realizada em 3 a 5 anos.
- Se um adenoma de alto risco for detectado, a próxima colonoscopia de vigilância deve ser realizada em 2 a 3 anos.
Adenomas de alto risco
- Três ou mais adenomas de qualquer tamnho.
- Adenoma avançado: adenoma tubular ≥ 10 mm; adenoma viloso e displasia de alto grau.
Pacientes com um adenoma de alto risco, em qualquer exame, parece permanecer como de alto risco ao longo da vida e devem ter intervalos de acompanhamento menor (por exemplo, 2 a 5 anos) para todas as colonoscopias de vigilância subsequentes.
Primeira vigilância
A primeira colonoscopia de vigilância nas pessoas com adenoma de alto risco (avançado - ≥10 mm, histologia vilosa ou displasia de alto grau) ou com 3 a 10 adenomas em sua colonoscopia, devem ser submetidos a uma primeira colonoscopia de vigilância em 2 a 3 anos.
Pacientes com mais de 10 adenomas devem ser avaliados para a síndrome de câncer colorretal hereditário e realizar colonoscopia de vigilância em 2 anos ou menos (veja as indicações para avaliação genética).
Pacientes com mais de 10 adenomas devem ser avaliados para a síndrome de câncer colorretal hereditário e realizar colonoscopia de vigilância em 2 anos ou menos (veja as indicações para avaliação genética).
Vigilância subsequente
O momento da colonoscopia de vigilância subsequente é baseado nos achados da primeira colonoscopia de vigilância.
- Se não forem encontrados adenomas na primeira colonoscopia de vigilância, a próxima colonoscopia de vigilância deve ser realizada em 3 a 5 anos. Pacientes com um adenoma de alto risco em qualquer exame permanece como alto risco e devem ter intervalos de 2 a 3 anos de acompanhamento para todas as colonoscopias de vigilância subsequentes.
- Se um adenoma de baixo risco for detectado, a próxima colonoscopia de vigilância deve ser realizada em 3 a 5 anos.
O intervalo de 5 a 10 anos é apenas para os pacientes de risco básico, na ausência de outros fatores de risco associados ao aumento do risco de câncer colorretal (por exemplo, câncer colorretal ou adenoma de alto risco em um parente de primeiro grau antes dos 60 anos de idade ou dois parentes de primeiro grau em qualquer idade).
* Se o resultado da segunda vigilância for negativo, não há evidências suficientes para fazer uma recomendação.
* Se o resultado da segunda vigilância for negativo, não há evidências suficientes para fazer uma recomendação.
Indicações para avaliação genética
Aproximadamente 5 a 10 por cento dos cânceres colorretais são atribuíveis a uma síndrome hereditária de predisposição ao câncer. Uma síndrome hereditária de predisposição ao câncer colorretal deve ser considerada em pacientes que se apresentam com idade precoce no diagnóstico do adenoma ou câncer, ou com números ou histologias incomuns de câncer ou condições pré-malignas. Por exemplo, em pacientes com 10 ou mais adenomas colorretais cumulativos ou qualquer número de adenomas em combinação com adenomas duodenais ou ampulares, tumores desmóides, câncer de tireoide papilar, cistos epidérmicos e osteomas, deve levantar a possibilidade de polipose adenomatosa familiar (PAF).
A cirurgia é o tratamento primário para os 80% dos cânceres colorretais que não apresentam metástase. A ferramenta mais poderosa para avaliar o prognóstico (expectativa de cura) é a análise anatomopatológica (biópsia) do câncer operado.
Apesar da cirurgia potencialmente curativa e do uso de quimioterapia adjuvante (após a cirurgia) moderna e/ou radioterapia (RT), mais de 40% dos pacientes que apresentam doença em estágio II ou III terão recorrência da doença após o tratamento inicial.
Programas intensivos de vigilância pós-operatória são justificados, na esperança de que o diagnóstico precoce de recorrências sem sintomas, aumente a proporção de pacientes que possam receber um segundo tratamento potencialmente curativo.
A vigilância intensiva também possibilita o diagnóstico precoce de um segundo câncer colorretal primário ou de pólipo colorretal.
A esmagadora maioria das recorrências tumorais desenvolve-se nos primeiros cinco anos e a maior parte nos primeiros dois a três anos após a cirurgia.
Em geral, as metástases hepáticas predominam, enquanto as metástases pulmonares ocorrem mais comumente em pacientes com câncer retal distal, uma vez que a drenagem venosa e linfática do reto distal não passa pelo fígado.
Sendo assim, a vigilância intensiva pós-operatória é recomendada para os pacientes com câncer colorretal ressecado em estágio II ou III com as seguintes medidas:
Sendo assim, a vigilância intensiva pós-operatória é recomendada para os pacientes com câncer colorretal ressecado em estágio II ou III com as seguintes medidas:
- Consulta médica a cada três a seis meses durante os primeiros três anos e a cada seis meses durante os anos 4 e 5.
- Nível de antígeno carcinoembrionário (CEA) sérico em cada visita de acompanhamento durante pelo menos os três primeiros anos.
- Tomografia computadorizada (TC) anual do tórax, abdome e pelve por pelo menos três anos.
- Colonoscopia completa pré-operatória para detectar lesões simultâneas, em seguida, repetir a colonoscopia um ano depois para excluir novas lesões, e se normal, intervalos subsequentes de acompanhamento de 1 a 3 anos, dependendo dos resultados da colonoscopia anterior.
- Para pacientes com câncer retal que sofreram ressecção anterior baixa e não receberam radioterapia pélvica (RT), sugiro a retossigmoidoscopia flexível a cada seis meses por três a cinco anos.
Colonoscopia pré-operatória (antes da cirurgia)
O câncer de colorretal sincrônico (simultâneo) é definido como dois ou mais tumores primários distintos e separados por intestino normal e não devido a extensão direta ou metástase.
Ocorrem em 2 a 5% dos pacientes com câncer colorretal. Todos os pacientes em tratamento para um câncer colorretal primário devem ser submetidos à colonoscopia para excluir cânceres e/ou pólipos sincrônicos (simultâneos).
Ocorrem em 2 a 5% dos pacientes com câncer colorretal. Todos os pacientes em tratamento para um câncer colorretal primário devem ser submetidos à colonoscopia para excluir cânceres e/ou pólipos sincrônicos (simultâneos).
A colonoscopia virtual por tomografia computadorizada (colonografia) é opção no pré-operatório em pacientes com tumores obstrutivos, quando a colonoscopia convencional não ultrapassa o câncer.
Se a colonoscopia convencional ou virtual, por algum motivo, não puderem ser realizados no pré-operatório, um deles deve ser realizado após a recuperação da cirurgia (geralmente dentro de seis meses após a cirurgia).
Vigilância endoscópica pós-operatória (após a cirurgia)
Embora o benefício sobre a sobrevida seja incerto, a vigilância periódica por colonoscopia após o tratamento é recomendada mundialmente.
Os objetivos da colonoscopia de vigilância após o tratamento são três:
- Detectar cânceres colorretais metacrônicos (novo câncer fora da anastomose - emenda do intestino - que são diagnosticados pelo menos seis meses após o diagnóstico inicial). Surge em 1,5 a 3% dos pacientes; no entanto, o risco permanece elevado por até 10 anos em alguns pacientes. Mais da metade surge nos primeiros 24 meses após o tratamento inicial e podem, às vezes, representar um câncer sincrônico que foi perdido inicialmente. A primeira colonoscopia é recomendada um ano após a cirurgia.
- Todos os pacientes com história de câncer colorretal tem um risco maior de desenvolver pólipos adenomatosos, precursor da maioria dos cânceres colorretais invasivos. O National Polyp Study demonstrou uma redução de 76 a 90% na incidência do câncer colorretal quando a colonoscopia de vigilância foi realizada e os pólipos removidos.
- Detectar a recorrência na anastomose do câncer em um estágio que permitiria novo tratamento curativo. Ocorre em 2 a 4% dos pacientes com câncer de cólon; as taxas são maiores em pacientes com câncer retal, particularmente em pacientes que não foram submetidos à excisão total do mesorreto e/ou radioterapia pélvica. Aproximadamente 90% das recidivas na anastomose ocorrem nos primeiros três anos.
Pacientes submetidos à colonoscopia de vigilância após a cirurgia para o câncer colorretal, apresentam mortalidade global mais baixa. Estudos não mostraram benefício de sobrevida ao realizar a colonoscopia em intervalos anuais ou mais curtos em comparação a intervalos menos frequentes (três ou cinco anos).
A incapacidade de demonstrar o benefício na sobrevida pela detecção precoce de recorrências anastomóticas, pode estar relacionada ao fato de que a grande maioria dos pacientes com recidivas anastomóticas detectadas por endoscopia são irressecáveis para a cura.
Por outro lado, a colonoscopia periódica demonstrou um claro benefício no diagnóstico do câncer metacrônico em um estágio curável cirurgicamente, bem como na prevenção de câncer metacrônico através da identificação e remoção de pólipos adenomatosos.
Rastreamento sugerido, segundo NCCN Guidelines for Patients®: Colon Cancer, 2018
Estágio I
Colonoscopia um ano após o tratamento
===a- Sem colonoscopia total prévia: 3-6 meses após o tratamento.
===b- Colonoscopia total prévia: 1 ano após o tratamento.
======Se não houver adenoma avançado, repita em 3 anos, depois a cada 3 a 5 anos.
======Se adenoma avançado, repetir em 1 ano. *Esses intervalos não se aplicam a pacientes com síndrome de Lynch.
Colonoscopia um ano após o tratamento
- Se não houver adenoma avançado, repetir em 3 anos, depois a cada 3 a 5 anos.
- Se adenoma avançado, repetir em 1 ano.
===a- Sem colonoscopia total prévia: 3-6 meses após o tratamento.
===b- Colonoscopia total prévia: 1 ano após o tratamento.
======Se não houver adenoma avançado, repita em 3 anos, depois a cada 3 a 5 anos.
======Se adenoma avançado, repetir em 1 ano. *Esses intervalos não se aplicam a pacientes com síndrome de Lynch.
Idosos
A decisão de interromper a colonoscopia de vigilância depende da expectativa de vida do paciente e se a probabilidade de encontrar um adenoma avançado ou um segundo câncer colorretal compensa o risco e a inconveniência da colonoscopia periódica.
As recomendações para vigilância contínua em idosos com câncer colorretal tratado são complicadas por outros fatores como: tamanho do cólon residual após a cirurgia e na presença ou não de adenomas avançados nas duas primeiras colonoscopias de vigilância.
No entanto, o maior risco de hospitalização após o procedimento e o impacto da comorbidade devem ser levados em consideração na avaliação dos riscos e benefícios relativos da colonoscopia periódica de vigilância.
Devido às discrepâncias nos dados e à escassez de diretrizes formais, pacientes com câncer de mama ou endométrio ou ovário são aconselhados a se submeterem ao rastreamento para o câncer colorretal com a colonoscopia, no momento do diagnóstico de um dos cânceres.
Repetir a cada 5 anos se normal, como resultado do aumento do risco para o câncer colorretal. Seguir as recomendações de acordo com os achados da primeira colonoscopia, como discutido acima no achado de pólipos.
Vigilância e manejo da displasia em pacientes com Doença Inflamatória Intestinal.
Como o risco do câncer colorretal encontra-se aumentado nos pacientes com a Doença Inflamatória Intestinal (DII), o objetivo da colonoscopia de vigilância é detectar a displasia, precursora do câncer colorretal e/ou o câncer colorretal em estágio precoce. A idade média de desenvolvimento do câncer colorretal nos pacientes com DII é menor do que para o câncer colorretal esporádico (40 a 50 anos versus 60 anos).
Retocolite Ulcerativa
A associação da retocolite ulcerativa com o câncer colorretal depende da duração, extensão e atividade da doença. Pacientes com colite prolongada e extensa (definida como colite por mais de 10 anos e envolvendo mais de 1/3 do cólon) têm um risco maior do câncer colorretal em comparação com a população geral.
➽Presença e gravidade da inflamação - A presença e gravidade da inflamação são importantes marcadores de risco. Nos pacientes com retocolite ulcerativa, a inflamação da mucosa (inflamação histológica e/ou endoscópica), a gravidade da inflamação, presença de pseudopólipos e estenoses estão associadas a um risco aumentado de câncer colorretal.
➽Idade no início da doença e duração da doença
São fatores de risco para o câncer colorretal nos pacientes com colite extensa.
São fatores de risco para o câncer colorretal nos pacientes com colite extensa.
➽Colite extensa
Pacientes com colite que compromete mais de 1/3 do cólon, apresentam maior risco de câncer colorretal. O risco começa a aumentar 8 a 10 anos após o início dos sintomas. Os riscos cumulativos do câncer colorretal após 10, 20 e mais de 20 anos de doença foram 1, 2 e 5%, respectivamente. É considerado de altíssimo risco os pacientes com colite extensa com diagnóstico antes dos 30 anos de idade.
Pacientes com colite que compromete mais de 1/3 do cólon, apresentam maior risco de câncer colorretal. O risco começa a aumentar 8 a 10 anos após o início dos sintomas. Os riscos cumulativos do câncer colorretal após 10, 20 e mais de 20 anos de doença foram 1, 2 e 5%, respectivamente. É considerado de altíssimo risco os pacientes com colite extensa com diagnóstico antes dos 30 anos de idade.
➽Colite do lado esquerdo
A maioria dos estudos demonstram que o risco para o câncer colorretal aumenta 15 a 20 anos após o diagnóstico, aproximadamente uma década a mais que na colite extensa.
A maioria dos estudos demonstram que o risco para o câncer colorretal aumenta 15 a 20 anos após o diagnóstico, aproximadamente uma década a mais que na colite extensa.
➽Retite (Proctite)
Pacientes com retite e retossigmoidite ulcerativa provavelmente apresentam risco somente um pouco aumentado para o câncer colorretal e não altera o intervalo de vigilância em relação às pessoas de risco médio.
Pacientes com retite e retossigmoidite ulcerativa provavelmente apresentam risco somente um pouco aumentado para o câncer colorretal e não altera o intervalo de vigilância em relação às pessoas de risco médio.
Doença de Crohn
O risco para o câncer colorretal na doença de Crohn de longa duração envolvendo o cólon é provavelmente comparável à da retocolite ulcerativa. O risco relativo do câncer colorretal foi de 2,5 em pacientes com Doença de Crohn e de 5,6 naqueles pacientes com doença restrita ao cólon.
O risco é ainda maior nos pacientes com menos de 30 anos no momento do diagnóstico comparado com aqueles diagnosticados após os 30 anos.
O câncer colorretal na Doença de Crohn é observado em um período semelhante ao da Retocolite Ulcerativa. A duração média da doença antes do diagnóstico do câncer colorretal é comparável nas doenças (15 e 18 anos, respectivamente). A idade média no diagnóstico do câncer colorretal é de 55 anos na Doença de Crohn e 43 anos na Retocolite Ulcerativa.
Achados Endoscópicos e Histológicos
Câncer colorretal
Na doença inflamatória intestinal (DII) o câncer colorretal aparece como massa nodular, ulcerada ou placas. Como no câncer colorretal esporádico, a maioria das lesões no cólon são adenocarcinomas. O câncer relacionado à DII ocorre em áreas com inflamação endoscópica e/ou histológica ativa.
Displasia
O epitélio displásico é um dos biomarcadores mais importantes para câncer e fornece, portanto, a justificativa para a vigilância. A displasia é um precursor do câncer colorretal associado à DII e pode ser encontrada em locais distantes do câncer, enquanto que a displasia no câncer colorretal esporádico, isto é, não associado a DII, é geralmente associada a um pólipo adenomatoso ou serrilhado sem inflamação. Os tumores síncronos são mais comuns na DII do que no câncer colorretal esporádico e podem ser encontrados no cólon, reto, ânus e tratos fistulosos internos ou externos.
Descrição endoscópica
A maioria das displasias na DII é visível à endoscopia. Termos como lesão ou massa associada à displasia (DALM) e DALM semelhante a adenoma ou não-adenoma, devem ser abandonados em favor da descrição das lesões usando a classificação de Paris. Veja aqui a CLASSIFICAÇÃO DE PARIS!
①- Displasia visível
Displasia identificada em biópsias dirigidas a uma lesão polipoide e não polipoide visualizada na colonoscopia.
Displasia identificada em biópsias dirigidas a uma lesão polipoide e não polipoide visualizada na colonoscopia.
②- Outras descrições endoscópicas
Ulcerada: ulceração (base de aparência fibrinosa com profundidade) dentro da lesão. Borda nítida: a borda da lesão embora discreta, é distinguida da mucosa circundante. Borda não nítida: a borda da lesão não pode ser distinguida da mucosa circundante.
Ulcerada: ulceração (base de aparência fibrinosa com profundidade) dentro da lesão. Borda nítida: a borda da lesão embora discreta, é distinguida da mucosa circundante. Borda não nítida: a borda da lesão não pode ser distinguida da mucosa circundante.
③- Displasia invisível
Displasia identificada em biópsias aleatórias (não direcionadas) da mucosa do cólon sem lesão visível.
Displasia identificada em biópsias aleatórias (não direcionadas) da mucosa do cólon sem lesão visível.
A localização da lesão deve ser identificada como dentro ou fora da área de colite conhecida e a descrição da lesão deve incluir:
➀- Morfologia - Polipoide (pediculada ou séssil) ou não polipoide (superficiais). Classificação de Paris.
➁- Bordas - Nítida ou não nítida.
➂- Características da invasão submucosa (se presente) - Depressão, ulceração ou falha em elevar na injeção de NaCl0,9% na submucosa.
➀- Morfologia - Polipoide (pediculada ou séssil) ou não polipoide (superficiais). Classificação de Paris.
➁- Bordas - Nítida ou não nítida.
➂- Características da invasão submucosa (se presente) - Depressão, ulceração ou falha em elevar na injeção de NaCl0,9% na submucosa.
Com base nas nestas características, as lesões podem ser classificadas como endoscopicamente ressecáveis ou endoscopicamente irressecáveis.
As lesões possíveis de tratamento endoscópico apresentam as seguintes características:
- Margens nítidas (quando identificadas com nitidez pela cromoendoscopia);
- Se eleva uniformemente após a injeção de NaCl0,9% na submucosa.
- Local da ressecção da lesão, na inspeção visual, sugere a remoção completa;
- O exame histológico da lesão ressecada mostra margens livres, demonstrando ressecção completa.
Quanto a presença da displasia ela pode ser:
- Negativa;
- Indeterminada;
- Positiva (com subgrupos de displasia de baixo grau e alto grau).
Histologicamente, a displasia pode ser difícil de distinguir da regeneração epitelial no contexto de inflamação ou ulceração da mucosa. A displasia deve ser confirmada por um patologista com experiência em DII, uma vez que a variabilidade interobservador é substancial, especialmente para discriminar alterações altamente reativas da displasia verdadeira.
Objetivo da Vigilância
O objetivo da vigilância nos pacientes com Doença Inflamatória Intestinal (DII) é detectar displasia, que está associada a um alto risco de câncer colorretal, e reduzir a mortalidade naqueles que desenvolvem o câncer de cólon. A incidência do câncer de cólon é maior naqueles que não realizam a colonoscopia de rastreamento.
A vigilância regular diagnostica o câncer colorretal em estágios mais precoces e melhora sobrevivência (8 versus 22%). Estratégias para melhorar a detecção da displasia são necessárias para reduzir o risco do câncer de intervalo na DII (o que surge nos pacientes regularmente rastreados), porque o câncer colorretal avançado pode ocorrer, apesar da vigilância.
Abordagem da Vigilância
Em todos os pacientes com Retocolite Ulcerativa e Doença de Crohn envolvendo um terço ou mais do cólon, a colonoscopia de rastreamento para o câncer colorretal é iniciada oito anos após o início da doença. Na colonoscopia de vigilância, é importante as biópsias para a histologia avaliar a cicatrização da mucosa e a extensão da atividade da doença.
Pacientes com retite (proctite) isolada ou doença envolvendo menos de um terço do cólon à colonoscopia de rastreamento também se inicia oito anos após o início da doença, para reavaliar a extensão da doença, uma vez que a colite pode progredir com o tempo.
Métodos de Vigilância
Cromoendoscopia
A única técnica que mostrou maior rendimento para a detecção das displasias é a cromoendoscopia com biópsias dirigidas às alterações encontradas.
A cromoendoscopia envolve a aplicação tópica de corantes de superfícies, como o Índigo Carmim 0,1 a 0,4%. Melhora a avaliação da superfície mucosa permitindo obter informações mais detalhadas e facilita a identificação das alterações na mucosa quanto ao seu tamanho, limites e localização.
Embora a maioria das diretrizes da sociedade defenderem a endoscopia de alta definição com a cromoendoscopia de superfície como a estratégia para otimizar a detecção das displasias, estudos adicionais a longo prazo são necessários para demonstrar a sua superioridade.
A cromoendoscopia parece ser superior a colonoscopia de luz branca padrão, mas sua superioridade em relação à endoscopia de luz branca de alta definição é menos clara.
Papel das Biópsias Aleatórias
Quando se tem segurança e experiência na cromoendoscopia, não são necessárias biópsias aleatórias. A técnica da cromoendoscopia associadas a biópsias aleatórias provavelmente maximiza a detecção da displasia e pode ser considerada para um grupo selecionado de maior risco
Ao usar um protocolo de biópsia aleatória para os exames de vigilância, várias biópsias aleatórias são necessárias para amostragem adequadamente o cólon. Quatro biópsias são obtidas a cada 10 cm do ceco ao reto para um total de no mínimo 33 biópsias. Biópsias adicionais são feitas no cólon sigmóide e no reto. Além disso, áreas de irregularidade da mucosa também devem ser biopsiadas.
Manejo dos Resultados Colonoscópicos de Rastreamento
Displasia polipoides
Os pólipos displásicos são ressecados endoscopicamente quando não estão associados com alterações displásicas na mucosa plana em outro local no cólon. Deve-se assegurar, pelo exame cuidadoso do local, a sua remoção completa, mas sempre complementado pelas biópsias na mucosa adjacente ao local ressecção (ALGORITMO), finalizando pela tatuagem do local.
Pólipos ≥10 mm ou retirados em fragmentos
A primeira colonoscopia de vigilância deve ser realizada em um a seis meses após e biopsias do local da ressecção devem ser obtidas para documentar a erradicação do tecido displásico. A segunda colonoscopia é realizada no 12º mês após a colonoscopia que removeu a lesão displásica, com os mesmos cuidados. Comprovado a erradicação da displasia a colonoscopia passa a ser anual.
A primeira colonoscopia de vigilância deve ser realizada em um a seis meses após e biopsias do local da ressecção devem ser obtidas para documentar a erradicação do tecido displásico. A segunda colonoscopia é realizada no 12º mês após a colonoscopia que removeu a lesão displásica, com os mesmos cuidados. Comprovado a erradicação da displasia a colonoscopia passa a ser anual.
Pólipos <10 mm
Para lesões polipoides menores ressecadas em bloco, a colonoscopia de vigilância pode ser realizada no intervalo de um ano. Se a colonoscopia de acompanhamento revelar que a ressecção do pólipo foi incompleta e a displasia ou o câncer residual for confirmada histologicamente, a cirurgia tornar-se-á necessária.
Para lesões polipoides menores ressecadas em bloco, a colonoscopia de vigilância pode ser realizada no intervalo de um ano. Se a colonoscopia de acompanhamento revelar que a ressecção do pólipo foi incompleta e a displasia ou o câncer residual for confirmada histologicamente, a cirurgia tornar-se-á necessária.
Displasia não-polipoide
As lesões não polipoides podem ser tecnicamente mais difíceis de ser retiradas, especialmente na presença de fibrose decorrente de inflamação prévia ou contínua. Pacientes com displasia não-polipoide devem ser tratados por um endoscopista com experiência em técnicas avançadas de ressecção endoscópica. O seguimento é o mesmo da retirada dos pólipos displásicos ≥10 mm.
Displasia Invisível
A displasia invisível é a displasia detectada em biópsias aleatórias (ou seja, não direcionadas) sem uma lesão visível associada. Pacientes com displasia invisível em biópsia aleatória devem ser encaminhados a um centro de DII que ofereça cromoendoscopia de alta definição. Uma discussão dos riscos e benefícios das estratégias de manejo deve ser discutida com o paciente.
Displasia unifocal de baixo grau
Embora o manejo da displasia invisível de baixo grau permaneça controverso, recomenda-se que a displasia invisível deva ser confirmada por um segundo patologista com experiência em DII e realizada uma segunda colonoscopia com cromoendoscopia de alta definição.
Biópsias dirigidas e aleatórias são novamente realizadas. As taxas de progressão da displasia de baixo grau para a displasia de alto grau e câncer variam de 0 a mais de 50% em estudos diversos, portanto, inconclusivas.
Displasia multifocal de baixo grau
Para pacientes com displasia invisível de baixo grau multifocal, detectada em biópsia aleatória durante a colonoscopia de vigilância e confirmada por um segundo patologista, recomenda-se a colonoscopia com cromoendoscopia por um endoscopista experiente.
A cromoendoscopia em pacientes com displasia invisível pode identificar uma lesão visível que pode ser passível de remoção endoscópica. As taxas de progressão da displasia invisível de baixo grau (identificadas por biópsias aleatórias usando colonoscopias de definição padrão) para displasia de alto grau ou câncer colorretal são variáveis, portanto, inconclusivas.
Displasia de alto grau
Pacientes com displasia de alto grau invisível devem ser avaliados por um endoscopista com experiência em vigilância da DII com cromoscopia de alta definição.
Caso a cromoscopia de alta definição identifique uma lesão que seja endoscopicamente ressecável, os estudos demonstram que a remoção curativa de lesões circunscritas pode ser realizada. A primeira colonoscopia de vigilância é recomendada em três a seis meses e depois anualmente. No entanto, isso pode variar dependendo dos achados da endoscopia e do julgamento do endoscopista especialista.
Se a displasia não for detectada pela cromoscopia de alta definição, a decisão sobre vigilância versus colectomia deve ser individualizada após a discussão dos riscos e benefícios das diferentes estratégias de manejo. Alternativamente, a Organização Europeia de Crohn e Colite e a Sociedade Americana para Endoscopia Gastrointestinal afirmam que a displasia de alto grau sem uma lesão endoscopicamente visível associada é indicação para cirurgia.
Pseudopólipos inflamatórios
Os pseudopólipos inflamatórios são ilhas de mucosa normal no cólon, embora de forma irregular, resultam da ulceração e regeneração da mucosa que ocorre na DII.
Quando as características típicas estão presentes, os pseudopólipos inflamatórios não não necessitam ser retirados, a menos que causem sintomas (por exemplo, sangramento ou obstrução).
Estenoses
Pacientes portadores da DII com estenose colorretal que não pode ser ultrapassada ou as biópsias adequadamente coletadas, devem ser encaminhados para cirurgia.
As estenoses podem complicar tanto a Doença de Crohn cólica como a Retocolite Ulcerativa, e sua presença requer vigilância cuidadosa devido ao risco aumentado do câncer colorretal.
Quimioprofilaxia
Embora vários agentes tenham sido avaliados para prevenção do câncer colorretal em pacientes com doença inflamatória intestinal (DII), nenhum demonstrou conclusivamente diminuir o risco do câncer colorretal. Na DII, acredita-se que o risco de câncer esteja relacionado à inflamação crônica. Um medicamento que reduz a inflamação pode levar a uma redução da neoplasia associada à colite.
A mesalazina é importante na indução e manutenção da remissão clínica e endoscópica na retocolite ulcerativa e para alguns pode reduzir a incidência do câncer colorretal. É assim recomendado para todos os pacientes com retocolite ulcerativa. Mesmos com dados conflitantes para o efeito quimiopreventivo do câncer colorretal. A mesalazina é de baixo risco, com um bom perfil de segurança, com efeito anti-inflamatório e potencial efeito protetor contra o colorretal.
Quando interromper a colonoscopia de prevenção do câncer colorretal em idosos? A interrupção deve ser considerada quando a expectativa de vida estimada for ≤ 10 anos.
Embora a colonoscopia de prevenção reduza em 50% a incidência do câncer colorretal em idosos (≥ 75 anos), em determinado momento ela deixa de aumentar significativamente a expectativa de vida e, portanto, não deve ser oferecida. Existem evidências e consensos claros sobre uma idade em que alguns pacientes não obtêm benefício com a colonoscopia de prevenção: homens ≥85
A colonoscopia de prevenção é potencialmente benéfica em homens ≤85 anos e mulheres ≤ 90 anos, sempre considerando as comorbidades e expectativa de vida, caso não tenha registro de uma colonoscopia sem pólipos nos últimos 10 anos. Pacientes mais jovens têm uma diminuição maior na expectativa de vida do que pacientes idosos após um diagnóstico de câncer colorretal.
Ao mesmo tempo, há uma redução de 75% no benefício da triagem para pacientes idosos em comparação com pacientes mais jovens.
Estudos mostraram que o benefício da triagem, após uma colonoscopia sem pólipos inicial, é reduzido em pacientes idosos, pois esse grupo tem maior chance de morrer de outras doenças além do câncer colorretal.
Em resumo: a saúde, expectativa de vida, condição funcional e idade são considerados quando se pensa em interromper o rastreamento do câncer colorretal. Recomenda-se uma abordagem individualizada reservando a colonoscopia a pacientes idosos (≥ 75 anos) saudáveis, quando a expectativa de vida for de 10 anos ou mais.
Para a escolha do preparo intestinal da colonoscopia responda as seguintes perguntas:
1. Já fez a colonoscopia antes com preparo ruim?
2. Com que frequência vai ao banheiro evacuar? Demora mais de 4 dias?
3. Faz uso de antidepressivo?
4. Quem vai fazer a colonoscopia é diabético ou possui alguma limitação física como sequela de AVC, demência, doença de Parkinson ou uso de cadeira de rodas ou muleta/bengala?
1. Já fez a colonoscopia antes com preparo ruim?
2. Com que frequência vai ao banheiro evacuar? Demora mais de 4 dias?
3. Faz uso de antidepressivo?
4. Quem vai fazer a colonoscopia é diabético ou possui alguma limitação física como sequela de AVC, demência, doença de Parkinson ou uso de cadeira de rodas ou muleta/bengala?
Preparo Especial de Urgência
Pacientes com Colostomia
|
1. Preparo para pacientes com COLOSTOMIA sem o coto retal: fazer o preparo igual aos pacientes SEM colostomia.
2. Preparo para pacientes com COLOSTOMIA com o coto retal: fazer o preparo igual aos demais pacientes, mas realizar também a lavagem do coto retal com o Fleet enema ou Phosfoenema---130ml---2 unidades. |
Isenção de responsabilidade
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.