Quais são as complicações da colonoscopia? O que posso sentir após a colonoscopia?
Embora a colonoscopia seja considerada um procedimento seguro, não é isenta de riscos. Quase um terço dos pacientes queixam-se de sintomas gastrointestinais transitórios após a colonoscopia, mas o risco de complicações graves, sangramento e perfuração, após a colonoscopia é baixo. Nas colonoscopias de rastreamento, complicações graves variam de 1,98 a 2,8 por 1000 exames. Mais de 85% destas complicações ocorrem no cenário da polipectomia.
Sonolência após a colonoscopia
Inchaço e dor abdominal após a colonoscopia
Constipação após a colonoscopia
Complicações do preparo de cólon da colonoscopia
Complicações da sedação da colonoscopia
Flebite (Tromboflebite) pós-punção de veia periférica
Sangramento da colonoscopia - Sangramento colorretal complicando a colonoscopia
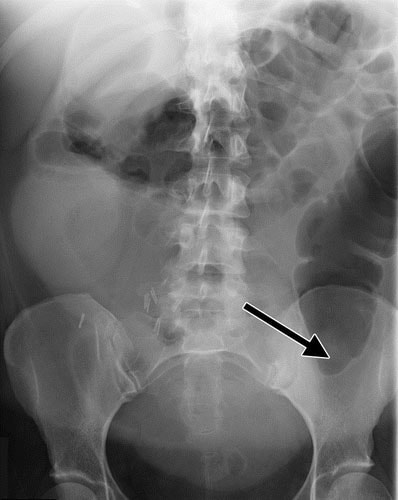
Perfuração da colonoscopia - Perfuração colorretal complicando a colonoscopia
Síndrome de coagulação pós-polipectomia
Inchaço e dor abdominal após a colonoscopia
Constipação após a colonoscopia
Complicações do preparo de cólon da colonoscopia
Complicações da sedação da colonoscopia
Flebite (Tromboflebite) pós-punção de veia periférica
Sangramento da colonoscopia - Sangramento colorretal complicando a colonoscopia
Perfuração da colonoscopia - Perfuração colorretal complicando a colonoscopia
Síndrome de coagulação pós-polipectomia
|
O câncer colorretal ocorrerá em 1 de 22 homens (4,5%) e 1 de 24 mulheres (4,2%) ao longo da vida. Para o Brasil, estimam-se, para cada ano do triênio de 2020-2022, 20.540 casos de câncer de cólon e reto em homens e 20.470 em mulheres. Esses valores correspondem a um risco estimado de 19,64 casos novos a cada 100 mil homens e 19,03 para cada 100 mil mulheres .
|
Sem considerar os tumores de pele não melanoma, o câncer de cólon e reto em homens é o segundo mais incidente nas Regiões Sudeste (28,62/100 mil) e Centro-Oeste (15,40/100 mil). Na Região Sul (25,11/100 mil), é terceiro tumor mais frequente. Enquanto nas Regiões Nordeste (8,91/100 mil) e Norte (5,43/100 mil), ocupa a quarta posição. Para as mulheres, é o segundo mais frequente nas Regiões Sudeste (26,18/100 mil) e Sul (23,65/100 mil). Nas Regiões Centro-Oeste (15,24/100 mil), Nordeste (10,79/100 mil) e Norte (6,48/100 mil) é o terceiro mais incidente.
A sobrevida de 5 anos após o diagnóstico de câncer colorretal é melhor para pacientes diagnosticados com câncer em estágio inicial, em oposição àqueles detectados em estágio mais avançado ou estágio metastático. Felizmente, o câncer colorretal geralmente surge lentamente ao longo do tempo. Programas de rastreamento e prevenção podem detectar o câncer precocemente ou até preveni-lo por meio da remoção de pólipos via colonoscopia.
Embora a colonoscopia seja considerada um procedimento seguro, não é isenta de riscos. Quase um terço dos pacientes queixam-se de sintomas gastrointestinais transitórios após a colonoscopia como: inchaço abdominal (25%), desconforto abdominal (10,5%), diarreia (6,3%), náusea (4%) e sangramento discreto (3,8%). Felizmente, as complicações graves são incomuns e incluem perfuração, hemorragia, complicações da sedação, complicações do preparo, complicações relacionadas a punção venosa, síndrome de coagulação pós-polipectomia e (raramente) ruptura esplênica.
O risco de complicações graves, sangramento e perfuração, após a colonoscopia é baixo. Nas colonoscopias de rastreamento, complicações graves variam de 1,98 a 2,8 por 1000 exames. Mais de 85% destas complicações ocorrem no cenário da polipectomia.
Os índices de mortalidade variam entre 0,006% e 0,5% e relacionam-se a complicações, como perfuração e hemorragia, principalmente em pacientes com graves comorbidades.
No entanto, o risco de colonoscopia não é constante entre os grupos. Os idosos têm maior risco de complicações graves em comparação com pacientes mais jovens. Pacientes com idade entre 80 e 84 anos têm uma taxa mais alta de complicações graves em comparação com pacientes com idade entre 66 e 69 anos (8.8 por 1000 procedimentos versus 5.0 por 1.000 procedimentos). O risco de complicações graves também está aumentado nos pacientes com certas doenças como: acidente vascular cerebral, doença pulmonar obstrutiva crônica, fibrilação atrial e insuficiência cardíaca.
A grande maioria das pessoas volta ao normal rapidamente e não sofre nenhuma dor ou desconforto grave durante ou após uma colonoscopia – e o exame pode salvar sua vida. Se você tem mais de 45 anos ou tem histórico familiar de câncer colorretal, converse com seu médico hoje sobre quando deve fazer a sua colonoscopia.
A sobrevida de 5 anos após o diagnóstico de câncer colorretal é melhor para pacientes diagnosticados com câncer em estágio inicial, em oposição àqueles detectados em estágio mais avançado ou estágio metastático. Felizmente, o câncer colorretal geralmente surge lentamente ao longo do tempo. Programas de rastreamento e prevenção podem detectar o câncer precocemente ou até preveni-lo por meio da remoção de pólipos via colonoscopia.
Embora a colonoscopia seja considerada um procedimento seguro, não é isenta de riscos. Quase um terço dos pacientes queixam-se de sintomas gastrointestinais transitórios após a colonoscopia como: inchaço abdominal (25%), desconforto abdominal (10,5%), diarreia (6,3%), náusea (4%) e sangramento discreto (3,8%). Felizmente, as complicações graves são incomuns e incluem perfuração, hemorragia, complicações da sedação, complicações do preparo, complicações relacionadas a punção venosa, síndrome de coagulação pós-polipectomia e (raramente) ruptura esplênica.
O risco de complicações graves, sangramento e perfuração, após a colonoscopia é baixo. Nas colonoscopias de rastreamento, complicações graves variam de 1,98 a 2,8 por 1000 exames. Mais de 85% destas complicações ocorrem no cenário da polipectomia.
Os índices de mortalidade variam entre 0,006% e 0,5% e relacionam-se a complicações, como perfuração e hemorragia, principalmente em pacientes com graves comorbidades.
No entanto, o risco de colonoscopia não é constante entre os grupos. Os idosos têm maior risco de complicações graves em comparação com pacientes mais jovens. Pacientes com idade entre 80 e 84 anos têm uma taxa mais alta de complicações graves em comparação com pacientes com idade entre 66 e 69 anos (8.8 por 1000 procedimentos versus 5.0 por 1.000 procedimentos). O risco de complicações graves também está aumentado nos pacientes com certas doenças como: acidente vascular cerebral, doença pulmonar obstrutiva crônica, fibrilação atrial e insuficiência cardíaca.
A grande maioria das pessoas volta ao normal rapidamente e não sofre nenhuma dor ou desconforto grave durante ou após uma colonoscopia – e o exame pode salvar sua vida. Se você tem mais de 45 anos ou tem histórico familiar de câncer colorretal, converse com seu médico hoje sobre quando deve fazer a sua colonoscopia.
Todos que se submetem ao exame de colonoscopia ficarão sonolentos em função dos efeitos da medicação sedativa. Você ficará na clínica após o procedimento em torno de 1 h, mas pode ser necessário mais tempo. Os efeitos da sedação podem durar até um dia, portanto você não deve dirigir ou operar máquinas até o dia seguinte. Você apenas será liberado para casa com um adulto responsável. Chegando em casa apenas descanse.
O ar é constantemente injetado no intestino durante a colonoscopia para o exame completo da parede intestinal, mesmo sendo aspirado no final do exame, a pequena quantidade de ar que fica é suficiente para causar os sintomas em algumas pessoas. Isso é normal e deve se resolver na primeira hora após o exame. Para acelerar a melhora é importante que solte este ar, caso tenha dificuldade, mudar de posição no sofá e uma leve massagem no abdome pode ajudar. Mas em alguns casos um certo desconforto pode permanecer por até 24 horas, portanto, mesmo estando em casa, procure fazer alguns movimentos para ajudar a eliminar os gases. Você também pode usar bebidas quentes, como chá de hortelã-pimenta.
O funcionamento intestinal pode mudar após a colonoscopia. Afinal, para realizar a colonoscopia é preciso limpar totalmente o intestino com o uso de laxantes, o que pode causar um desequilíbrio temporário. Como consequência, algumas pessoas podem apresentar constipação transitória por alguns dias. Geralmente, esse efeito dura pouco tempo e logo a pessoa volta ao seu ritmo de evacuação habitual. Portadores da síndrome do intestino irritável e outras doenças como doenças inflamatórias intestinais podem apresentar uma piora nos sintomas após a colonoscopia. Entretanto, a maioria dos pacientes notam que a frequência de evacuação volta ao normal nos primeiros dias que se seguem ao exame. Nos casos em que este desarranjo intestinal persiste, o uso de probióticos e reguladores intestinais, podem acelerar o retorno do hábito intestinal antes do exame
|
Alguns eventos adversos estão associados à desidratação, porque durante a preparação intestinal grandes quantidades de líquido são perdidas com as várias evacuações líquidas. É importante abordar questões de segurança relacionadas à desidratação por meio de triagem, reforçando a importância de manter a hidratação adequada antes, durante e após o preparo intestinal.
|
Portanto, a orientação adequada do paciente pode melhorar a aceitação do preparo intestinal, promover a adesão e aumentar a probabilidade de um procedimento bem-sucedido e, por fim, reduzir o risco de eventos adversos relacionados à desidratação.
Hidratação pós-colonoscopia. O paciente deve ser encorajado a continuar a hidratação após a colonoscopia. Os pacientes devem ser instruídos a consumir um mínimo de 4 a 8 copos de 250 ml de líquido durante o período de 8h após a conclusão da colonoscopia; esta recomendação pode ser reforçada incluindo-a nas instruções de alta aos pacientes.
Os pacientes que se preparam para uma colonoscopia com ingestão de grandes volumes de líquidos podem se beneficiar ao receber rotineiramente uma medicação para vômitos durante o processo de preparação, especialmente quando tiver tendência a náuseas e vômitos.
Os pacientes que se preparam para uma colonoscopia com ingestão de grandes volumes de líquidos podem se beneficiar ao receber rotineiramente uma medicação para vômitos durante o processo de preparação, especialmente quando tiver tendência a náuseas e vômitos.
|
A pseudo-obstrução aguda do cólon (síndrome de Ogilvie) raramente é observada durante o preparo para a colonoscopia. É caracterizada por sinais e sintomas de obstrução do cólon na ausência de uma causa mecânica (tumor ou inflamatória). A principal característica clínica é a dor e distensão abdominal. A distensão abdominal ocorre após o início do preparo principal para a colonoscopia e piora rapidamente, porque o paciente não consegue eliminar as fezes e gases. É mais comumente encontrada em idosos com múltiplas comorbidades subjacentes, mas também pode se desenvolver em pacientes saudáveis após uma lesão traumática, após uma cirurgia e em uso de medicamentos opioides e antidepressivos.
|
A descompressão colônica pela colonoscopia é necessária e urgente para evitar complicações isquêmicas e perfurativas, mesmo com o preparo inadequado. Apenas se consegue descomprimir totalmente o cólon quando o ângulo esplênico é ultrapassado com o colonoscópio. A melhora é imediata após a retirado do colonoscópio.
|
A sedação e a analgesia são elementos importantes para a colonoscopia. A sedação para colonoscopia visa aliviar o desconforto e a ansiedade do paciente, melhorar o resultado do exame, diminuir a memória do paciente sobre o evento e obter um procedimento endoscópico confortável e tecnicamente bem-sucedido.
|
Em pacientes submetidos a colonoscopia, a dosagem inadequada de hipnóticos (propofol), sedativos (midazolam) e analgésicos opioides (fentanil) durante a sedoanalgesia intravenosa pode deixar o paciente acordado durante o procedimento de modo que sinta dor durante e após o exame, bem como causar náuseas e vômitos após a colonoscopia, principalmente pela dosagem inadequada do opioide fentanil.
Graças ao seu rápido início de ação (<1 min) e curta duração (aproximadamente 4-8 min), o propofol é o hipnótico intravenoso mais popular, aplicado isoladamente durante a colonoscopia ou em combinação com outras drogas como o fentanil, que é opioide mais popular com rápido início (cerca de 2 min) e curta duração (aproximadamente 30 min) associado ou não ao benzodiazepínico midazolam.
As complicações relacionadas à sedação da colonoscopia são geralmente cardiovasculares, pulmonares e ocasionalmente neurológicas. Flutuações na frequência cardíaca e/ou saturação de oxigênio são relativamente comuns, mas são geralmente leve e provavelmente de menor relevância clínica
Complicações significativas são hipóxia prolongada, arritmias cardíacas, síndrome vasovagal, hiper ou hipotensão e isquemia miocárdica. Os fatores de risco que predispõem a eventos adversos cardiopulmonares incluem idade avançada, comorbidades associadas (principalmente doenças pulmonares), anemia, presença de sangramento ativo, obesidade, procedimentos de longa duração ou de emergência e classe III-IV da Sociedade Americana de Anestesiologia (ASA)
Sistema de Classificação da Sociedade Americana de Anestesiologistas (ASA).
ASA-I Paciente normal e saudável.
ASA-II Paciente com doença sistêmica leve.
ASA-III Paciente com doença sistêmica grave.
ASA-IV Paciente com doença sistêmica grave que é uma ameaça constante à vida.
ASA-V Paciente moribundo que não deve sobreviver sem a cirurgia.
ASA-VI Paciente com morte cerebral declarada cujos órgãos estão sendo removidos para fins de doação.
ASA-E Operação de emergência de qualquer variedade (usada para modificar uma das classificações acima, ou seja, ASA III-E)
Em geral, o paciente quando internado, acompanhado por estagiários e sob oxigênio suplementar, este último por possivelmente mascarar hipercapnia (produção aumentada de dióxido de carbono) e hipoventilação, estão associados a um maior risco de eventos cardiopulmonares não antecipados pelo risco cirúrgico. O período de monitoramento para a “taxa de evento adverso” inclui os primeiros 30 dias pós-procedimento.
Náuseas e vômitos são efeitos adversos incomuns da sedação para a colonoscopia. São uma das principais causas de insatisfação do paciente e podem levar a permanência prolongada na recuperação e custos mais elevados de atendimento. Muitos medicamentos antieméticos estão disponíveis para o tratamento.
As principais causas das náuseas e vômitos pós colonoscopia é o jejum prolongado porque causa um acúmulo desnecessário de ácido estomacal e piora a desidratação causada pelo preparo intestinal. Por isso é importante a ingestão de líquidos claros até duas horas antes do procedimento para manter-se hidratado e reduzir a acidez estomacal.
Pessoas com história pregressa de vômitos em exames que usaram sedativos e naqueles que relatam apresentar vômitos com frequência podem se beneficiar de medicamentos antieméticos preventivos, como a ondansetrona.
Outra complicação bastante comum da colonoscopia diagnóstica é a reação vasovagal. Embora não existam dados específicos publicados sobre a incidência de reações vasovagais, a experiência clínica sugere que não é um evento raro. O paciente pode tornar-se transitoriamente bradicárdico e hipotenso, acabando por vezes, por perder a consciência.
A reação vasovagal geralmente é resultado da distensão gasosa do cólon pela injeção de ar para a abertura da luz intestinal, formação de alça na presença de um sigmoide alongado e de uma intubação dolorosa, especialmente na presença de um mesossigmoide curto ou, mesmo, ansiedade do paciente. A doença diverticular espástica grave do cólon sigmoide está associado ao aparecimento da reação vasovagal, assim como as altas doses de midazolam ou diazepan aplicados para sedação.
O tratamento envolve, primariamente, a remoção do colonoscópio com aspiração do ar, reposição de líquidos intravenosos e colocação do doente em posição de Trendelenburg (o paciente é levemente inclinado para que a cabeça do paciente fique mais baixo que seus pés em alguns graus), assim com a aspiração de qualquer agente insuflador em excesso. O paciente pode precisar de flumazenil, no caso de terem sido administradas benzodiazepínicos (midazolam), ou naloxona, naquelas situações em
que forem administrados narcóticos opioides (fentanil). Normalmente, os pacientes melhoram ao fim de
algum tempo, sem a necessidade de mais medicação.
A hipoxemia, que geralmente é transitória, mas causa de ansiedade para o colonoscopista, é uma ocorrência comum durante a sedação para colonoscopia e levou à prática “rotineira” do uso suplementar de oxigênio durante a colonoscopia. A hipoxemia prolongada associada à colonoscopia é rara.
Pacientes com doença pulmonar obstrutiva crônica (DPOC) grave apresentam risco aumentado de hipercapnia (aumento de dióxido de carbono, CO2, no sangue) durante a colonoscopia. Portanto, a sedação nesses pacientes deve ser adequadamente balanceada e o exame endoscópico deve ser descontinuado em caso de dificuldade excessiva na progressão do colonoscópio ou dor excessiva durante o procedimento.
A etiologia da hipoxemia é muitas vezes multifatorial, mas a quantidade de ar insuflado no cólon para abrir adequadamente a luz intestinal não deve ser negligenciada e, em alguns casos, este gás passa para o intestino delgado através de uma válvula ileocecal incompetente, atrapalhando a função diafragmática e agravando a dessaturação. Isso tem levado a maioria dos colonoscopistas a monitorar periodicamente o grau de distensão abdominal pela palpação direta do abdome durante o procedimento ou quando há queda na saturação de oxigênio.
A etiologia da hipotensão durante a colonoscopia também é multifatorial (medicamentos anti-hipertensivos pré-procedimento, sedativos e analgésicos usados durante a realização do procedimento, arritmias, estado de desempenho cardíaco pré-procedimento etc.), mas a desidratação secundária ao preparo intestinal do paciente após o exame predomina entre os fatores a serem considerados. A reposição intravenosa durante o exame com soluções cristaloides (soro fisiológico) minimiza o risco de hipotensão e deve, portanto, ser rotineira.
Arritmias cardíacas com bradicardia e menos frequentemente taquicardia, extrassístoles atriais, paroxismos de fibrilação atrial e extrassístoles ventriculares podem ocorrer durante a sedação. A maioria resolve com o aumento da reposição intravenosa de soluções cristaloides (soro fisiológico) e/ou aumento da sedação.
Em relação à bradicardia, existe a bradicardia assintomática (frequência cardíaca menor que 60 bpm) e bradicardia sintomática definida como frequência cardíaca menor que 60/min que desencadeia sinais e sintomas. Na bradicardia sintomática, a frequência cardíaca geralmente é inferior a 50/min. A bradicardia sintomática existe quando os 3 critérios seguintes estão presentes: 1.) A frequência cardíaca é < 60/min; 2.) O paciente apresenta sintomas; e 3.) Os sintomas são devidos a bradicardia.
A atropina é a primeira droga de escolha para a bradicardia sintomática. A dose é de 0,5 mg IV, que pode ser repetido até uma dose total de 3 mg. A dopamina é uma droga de segunda linha para a bradicardia sintomática quando a atropina não é eficaz. A dosagem é de 2-10 microgramas/kg/min de infusão. A epinefrina pode ser usada como uma alternativa igual à dopamina quando a atropina não é eficaz. A dosagem é de 2-10 microgramas/min.
Casos raros de taquicardia ventricular e parada cardíaca durante fibrilação ventricular foram relatados, necessitando de monitorização contínua e disponibilidade de pessoal treinado, bem como a obtenção de um histórico de doença cardíaca ou pulmonar antes de iniciar o procedimento.
Embora a prevalência de embolia pulmonar coexistente no momento da detecção do câncer de cólon tenha sido estimada em 2% (com a prevalência concomitante de trombose venosa profunda chegando a 8%), não há estatísticas aceitas para a incidência de embolia complicando a colonoscopia diagnóstica ou terapêutica.
O risco de acidente vascular cerebral em pacientes com fibrilação atrial cuja anticoagulação é ajustada para endoscopias é baixo, mas quase dez vezes maior em pacientes com situações clínicas complexas. Idade, história de acidente vascular cerebral, hipertensão, hiperlipidemia e história familiar de doença vascular podem aumentar o risco de um acidente vascular cerebral durante ou imediatamente após um procedimento endoscópico gastrointestinal.
Diretrizes abrangentes para o manejo da anticoagulação e terapia antiplaquetária em pacientes submetidos a procedimentos endoscópicos gastrointestinais, incluindo colonoscopia, foram publicadas recentemente e devem servir como referência e guia ao lidar com esses pacientes.
O infarto do miocárdio recente tradicionalmente impede a realização de colonoscopia eletiva por alguns meses, mas recentemente esse assunto tem sido mais abordado pela literatura. A colonoscopia realizada em pacientes que sofreram um infarto do miocárdio recente está associada a uma taxa mais alta de complicações menores e transitórias, principalmente cardiovasculares quando comparada com pacientes controle, mas complicações maiores são relativamente raras.
Em certas circunstâncias, apesar do maior risco, a colonoscopia pode ser benéfica nesse cenário, principalmente devido à maior frequência de colite isquêmica nessa população de pacientes. A ocorrência de isquemia cardíaca (e distúrbios concomitantes do ritmo cardíaco) em pacientes submetidos à colonoscopia com doença cardíaca conhecida ou fatores de risco cardíaco foi recentemente quantificada. Os registros mostraram uma alta incidência de alterações eletrocardiográficas isquêmicas e novas arritmias silenciosas durante a colonoscopia em pacientes com um ou mais fatores de risco para doença cardíaca.
Graças ao seu rápido início de ação (<1 min) e curta duração (aproximadamente 4-8 min), o propofol é o hipnótico intravenoso mais popular, aplicado isoladamente durante a colonoscopia ou em combinação com outras drogas como o fentanil, que é opioide mais popular com rápido início (cerca de 2 min) e curta duração (aproximadamente 30 min) associado ou não ao benzodiazepínico midazolam.
As complicações relacionadas à sedação da colonoscopia são geralmente cardiovasculares, pulmonares e ocasionalmente neurológicas. Flutuações na frequência cardíaca e/ou saturação de oxigênio são relativamente comuns, mas são geralmente leve e provavelmente de menor relevância clínica
Complicações significativas são hipóxia prolongada, arritmias cardíacas, síndrome vasovagal, hiper ou hipotensão e isquemia miocárdica. Os fatores de risco que predispõem a eventos adversos cardiopulmonares incluem idade avançada, comorbidades associadas (principalmente doenças pulmonares), anemia, presença de sangramento ativo, obesidade, procedimentos de longa duração ou de emergência e classe III-IV da Sociedade Americana de Anestesiologia (ASA)
Sistema de Classificação da Sociedade Americana de Anestesiologistas (ASA).
ASA-I Paciente normal e saudável.
ASA-II Paciente com doença sistêmica leve.
ASA-III Paciente com doença sistêmica grave.
ASA-IV Paciente com doença sistêmica grave que é uma ameaça constante à vida.
ASA-V Paciente moribundo que não deve sobreviver sem a cirurgia.
ASA-VI Paciente com morte cerebral declarada cujos órgãos estão sendo removidos para fins de doação.
ASA-E Operação de emergência de qualquer variedade (usada para modificar uma das classificações acima, ou seja, ASA III-E)
Em geral, o paciente quando internado, acompanhado por estagiários e sob oxigênio suplementar, este último por possivelmente mascarar hipercapnia (produção aumentada de dióxido de carbono) e hipoventilação, estão associados a um maior risco de eventos cardiopulmonares não antecipados pelo risco cirúrgico. O período de monitoramento para a “taxa de evento adverso” inclui os primeiros 30 dias pós-procedimento.
- Náuseas e vômitos na sedação para a colonoscopia
Náuseas e vômitos são efeitos adversos incomuns da sedação para a colonoscopia. São uma das principais causas de insatisfação do paciente e podem levar a permanência prolongada na recuperação e custos mais elevados de atendimento. Muitos medicamentos antieméticos estão disponíveis para o tratamento.
As principais causas das náuseas e vômitos pós colonoscopia é o jejum prolongado porque causa um acúmulo desnecessário de ácido estomacal e piora a desidratação causada pelo preparo intestinal. Por isso é importante a ingestão de líquidos claros até duas horas antes do procedimento para manter-se hidratado e reduzir a acidez estomacal.
Pessoas com história pregressa de vômitos em exames que usaram sedativos e naqueles que relatam apresentar vômitos com frequência podem se beneficiar de medicamentos antieméticos preventivos, como a ondansetrona.
- Reação vasovagal na sedação para a colonoscopia
Outra complicação bastante comum da colonoscopia diagnóstica é a reação vasovagal. Embora não existam dados específicos publicados sobre a incidência de reações vasovagais, a experiência clínica sugere que não é um evento raro. O paciente pode tornar-se transitoriamente bradicárdico e hipotenso, acabando por vezes, por perder a consciência.
A reação vasovagal geralmente é resultado da distensão gasosa do cólon pela injeção de ar para a abertura da luz intestinal, formação de alça na presença de um sigmoide alongado e de uma intubação dolorosa, especialmente na presença de um mesossigmoide curto ou, mesmo, ansiedade do paciente. A doença diverticular espástica grave do cólon sigmoide está associado ao aparecimento da reação vasovagal, assim como as altas doses de midazolam ou diazepan aplicados para sedação.
O tratamento envolve, primariamente, a remoção do colonoscópio com aspiração do ar, reposição de líquidos intravenosos e colocação do doente em posição de Trendelenburg (o paciente é levemente inclinado para que a cabeça do paciente fique mais baixo que seus pés em alguns graus), assim com a aspiração de qualquer agente insuflador em excesso. O paciente pode precisar de flumazenil, no caso de terem sido administradas benzodiazepínicos (midazolam), ou naloxona, naquelas situações em
que forem administrados narcóticos opioides (fentanil). Normalmente, os pacientes melhoram ao fim de
algum tempo, sem a necessidade de mais medicação.
- Hipoxemia e Hipercapnia na sedação para a colonoscopia
A hipoxemia, que geralmente é transitória, mas causa de ansiedade para o colonoscopista, é uma ocorrência comum durante a sedação para colonoscopia e levou à prática “rotineira” do uso suplementar de oxigênio durante a colonoscopia. A hipoxemia prolongada associada à colonoscopia é rara.
Pacientes com doença pulmonar obstrutiva crônica (DPOC) grave apresentam risco aumentado de hipercapnia (aumento de dióxido de carbono, CO2, no sangue) durante a colonoscopia. Portanto, a sedação nesses pacientes deve ser adequadamente balanceada e o exame endoscópico deve ser descontinuado em caso de dificuldade excessiva na progressão do colonoscópio ou dor excessiva durante o procedimento.
A etiologia da hipoxemia é muitas vezes multifatorial, mas a quantidade de ar insuflado no cólon para abrir adequadamente a luz intestinal não deve ser negligenciada e, em alguns casos, este gás passa para o intestino delgado através de uma válvula ileocecal incompetente, atrapalhando a função diafragmática e agravando a dessaturação. Isso tem levado a maioria dos colonoscopistas a monitorar periodicamente o grau de distensão abdominal pela palpação direta do abdome durante o procedimento ou quando há queda na saturação de oxigênio.
- Hipotensão na sedação para a colonoscopia
A etiologia da hipotensão durante a colonoscopia também é multifatorial (medicamentos anti-hipertensivos pré-procedimento, sedativos e analgésicos usados durante a realização do procedimento, arritmias, estado de desempenho cardíaco pré-procedimento etc.), mas a desidratação secundária ao preparo intestinal do paciente após o exame predomina entre os fatores a serem considerados. A reposição intravenosa durante o exame com soluções cristaloides (soro fisiológico) minimiza o risco de hipotensão e deve, portanto, ser rotineira.
- Arritmia na sedação para a colonoscopia
Arritmias cardíacas com bradicardia e menos frequentemente taquicardia, extrassístoles atriais, paroxismos de fibrilação atrial e extrassístoles ventriculares podem ocorrer durante a sedação. A maioria resolve com o aumento da reposição intravenosa de soluções cristaloides (soro fisiológico) e/ou aumento da sedação.
Em relação à bradicardia, existe a bradicardia assintomática (frequência cardíaca menor que 60 bpm) e bradicardia sintomática definida como frequência cardíaca menor que 60/min que desencadeia sinais e sintomas. Na bradicardia sintomática, a frequência cardíaca geralmente é inferior a 50/min. A bradicardia sintomática existe quando os 3 critérios seguintes estão presentes: 1.) A frequência cardíaca é < 60/min; 2.) O paciente apresenta sintomas; e 3.) Os sintomas são devidos a bradicardia.
A atropina é a primeira droga de escolha para a bradicardia sintomática. A dose é de 0,5 mg IV, que pode ser repetido até uma dose total de 3 mg. A dopamina é uma droga de segunda linha para a bradicardia sintomática quando a atropina não é eficaz. A dosagem é de 2-10 microgramas/kg/min de infusão. A epinefrina pode ser usada como uma alternativa igual à dopamina quando a atropina não é eficaz. A dosagem é de 2-10 microgramas/min.
Casos raros de taquicardia ventricular e parada cardíaca durante fibrilação ventricular foram relatados, necessitando de monitorização contínua e disponibilidade de pessoal treinado, bem como a obtenção de um histórico de doença cardíaca ou pulmonar antes de iniciar o procedimento.
- Embolia pulmonar na sedação para a colonoscopia
Embora a prevalência de embolia pulmonar coexistente no momento da detecção do câncer de cólon tenha sido estimada em 2% (com a prevalência concomitante de trombose venosa profunda chegando a 8%), não há estatísticas aceitas para a incidência de embolia complicando a colonoscopia diagnóstica ou terapêutica.
- Ataque transitório isquêmico e AVC na sedação para a colonoscopia
O risco de acidente vascular cerebral em pacientes com fibrilação atrial cuja anticoagulação é ajustada para endoscopias é baixo, mas quase dez vezes maior em pacientes com situações clínicas complexas. Idade, história de acidente vascular cerebral, hipertensão, hiperlipidemia e história familiar de doença vascular podem aumentar o risco de um acidente vascular cerebral durante ou imediatamente após um procedimento endoscópico gastrointestinal.
Diretrizes abrangentes para o manejo da anticoagulação e terapia antiplaquetária em pacientes submetidos a procedimentos endoscópicos gastrointestinais, incluindo colonoscopia, foram publicadas recentemente e devem servir como referência e guia ao lidar com esses pacientes.
- Infarto do miocárdio na sedação para a colonoscopia
O infarto do miocárdio recente tradicionalmente impede a realização de colonoscopia eletiva por alguns meses, mas recentemente esse assunto tem sido mais abordado pela literatura. A colonoscopia realizada em pacientes que sofreram um infarto do miocárdio recente está associada a uma taxa mais alta de complicações menores e transitórias, principalmente cardiovasculares quando comparada com pacientes controle, mas complicações maiores são relativamente raras.
Em certas circunstâncias, apesar do maior risco, a colonoscopia pode ser benéfica nesse cenário, principalmente devido à maior frequência de colite isquêmica nessa população de pacientes. A ocorrência de isquemia cardíaca (e distúrbios concomitantes do ritmo cardíaco) em pacientes submetidos à colonoscopia com doença cardíaca conhecida ou fatores de risco cardíaco foi recentemente quantificada. Os registros mostraram uma alta incidência de alterações eletrocardiográficas isquêmicas e novas arritmias silenciosas durante a colonoscopia em pacientes com um ou mais fatores de risco para doença cardíaca.
As complicações locais mais frequentes são: hematoma, infiltração, flebite, tromboflebite, trombose e infecção local. Ocorrem como reações adversas ou traumas ao redor do local da punção, sendo reconhecidas precocemente por avaliação objetiva dos sinais e sintomas.
A flebite é uma inflamação aguda comumente associada à terapia com cateteres de acesso venoso e sua origem pode ser mecânica, química ou bacteriana. A flebite é considerada a complicação local mais comum de cateteres intravenosos.
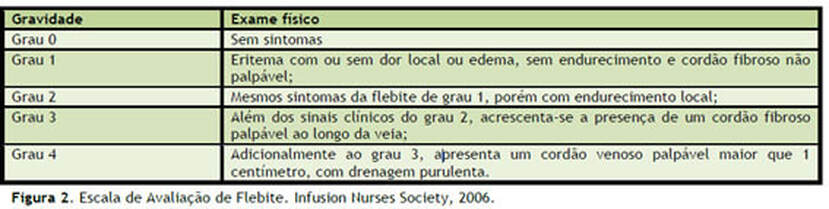
A flebite caracteriza-se por uma inflamação aguda da veia, causando edema, dor, desconforto, eritema ao redor da punção e um "cordão" palpável ao longo do trajeto.
A flebite caracteriza-se por uma inflamação aguda da veia, causando edema, dor, desconforto, eritema ao redor da punção e um "cordão" palpável ao longo do trajeto.
As principais complicações da flebite envolvem processo infeccioso secundário e formação de trombos no sistema venoso profundo.
O processo inflamatório da flebite pode ocasionar formação de pequenos coágulos na circulação venosa superficial, chamada de tromboflebite. Quando as veias axiais maiores estão envolvidas, pode ocorrer propagação para o sistema venoso profundo, com risco de desenvolver trombose venosa profunda (TVP) e embolia pulmonar.
Fatores de risco para trombose venosa profunda em pessoas com flebite e trombose das veias dos membros inferiores incluem trombose mais extensa ≥5 cm, proximidade anatômica do trombo ao sistema venoso profundo e fatores de risco médicos para TVP.
Nos casos não complicados, orientamos apenas compressa morna, anti-inflamatórios e analgésicos; nos casos de sintomatologia mais exuberante, podem ser usados anticoagulantes. Para pacientes com alto risco para TVP, está indicado anticoagulação oral por 45 dias. Heparina de baixo peso molecular, heparina não fracionada, anticoagulantes orais diretos e antagonistas da vitamina K parecem ser igualmente eficazes. Para trombo que se estende até o sistema venoso profundo, o paciente é tratado de acordo com os protocolos padrão para TVP.
O diclofenaco de gel tópico parece ser tão eficaz quanto o diclofenaco oral no alívio da dor, mas pode estar associado à hepatotoxicidade. Em um estudo randomizado, a heparina tópica (cumarina e heparina sódica), aplicada 3x/dia por até 7 dias, mostrou-se mais eficaz que o placebo.
Importante saber que a maioria dos casos tem evolução favorável, com remissão dos sintomas em 1-3 semanas de tratamento. A veia pode continuar palpável por semanas a meses, contudo, apesar de sentir o “cordão endurecido” no trajeto da veia, não há mais dor ao palpá-la.
Na literatura verificou-se que as veias cubitais (junção entre o antebraço e braço) estão associadas a taxas menores de flebite quando comparadas às veias da mão.
A melhor prevenção para as complicações relacionadas ao acesso venoso está diretamente ligada a: escolha de veias mais calibrosas; escolha do menor dispositivo indicado à infusão; fixação adequada para prevenir irritação mecânica; punções realizadas por profissionais habilitados; higienização adequada das mãos.
O processo inflamatório da flebite pode ocasionar formação de pequenos coágulos na circulação venosa superficial, chamada de tromboflebite. Quando as veias axiais maiores estão envolvidas, pode ocorrer propagação para o sistema venoso profundo, com risco de desenvolver trombose venosa profunda (TVP) e embolia pulmonar.
Fatores de risco para trombose venosa profunda em pessoas com flebite e trombose das veias dos membros inferiores incluem trombose mais extensa ≥5 cm, proximidade anatômica do trombo ao sistema venoso profundo e fatores de risco médicos para TVP.
Nos casos não complicados, orientamos apenas compressa morna, anti-inflamatórios e analgésicos; nos casos de sintomatologia mais exuberante, podem ser usados anticoagulantes. Para pacientes com alto risco para TVP, está indicado anticoagulação oral por 45 dias. Heparina de baixo peso molecular, heparina não fracionada, anticoagulantes orais diretos e antagonistas da vitamina K parecem ser igualmente eficazes. Para trombo que se estende até o sistema venoso profundo, o paciente é tratado de acordo com os protocolos padrão para TVP.
O diclofenaco de gel tópico parece ser tão eficaz quanto o diclofenaco oral no alívio da dor, mas pode estar associado à hepatotoxicidade. Em um estudo randomizado, a heparina tópica (cumarina e heparina sódica), aplicada 3x/dia por até 7 dias, mostrou-se mais eficaz que o placebo.
Importante saber que a maioria dos casos tem evolução favorável, com remissão dos sintomas em 1-3 semanas de tratamento. A veia pode continuar palpável por semanas a meses, contudo, apesar de sentir o “cordão endurecido” no trajeto da veia, não há mais dor ao palpá-la.
Na literatura verificou-se que as veias cubitais (junção entre o antebraço e braço) estão associadas a taxas menores de flebite quando comparadas às veias da mão.
A melhor prevenção para as complicações relacionadas ao acesso venoso está diretamente ligada a: escolha de veias mais calibrosas; escolha do menor dispositivo indicado à infusão; fixação adequada para prevenir irritação mecânica; punções realizadas por profissionais habilitados; higienização adequada das mãos.
Um achado importante das revisões sistemáticas recentes é a diminuição nos últimos 15 anos das taxas de “sangramento” pós-colonoscopia clinicamente significativo. Isso contrasta com o aumento substancial da taxa geral de polipectomia, especialmente ressecção endoscópica de pólipos maiores não pediculados (previamente encaminhados para cirurgia). Intuitivamente, o aumento da quantidade e a dificuldade técnica das polipectomias levariam a um maior índice de complicações hemorrágicas.
Apesar dos procedimentos mais frequentes e desafiadores, existe uma tendência estabilizadora para “perfurações” e “mortalidade” e uma taxa decrescente de “sangramento” pós-colonoscopia. Esses resultados são provavelmente devido ao avanço tecnológico dos equipamentos para colonoscopia, melhora da técnica de realização da colonoscopia e retirada de pólipos e especialmente na evolução da formação e treinamento do colonoscopista.
A incidência geral do sangramento varia de 1 a 6 por 1.000 colonoscopias com retirada de pólipos. O tamanho do pólipo é relatado como o fator de risco mais relevante para o sangramento pós-polipectomia. Fatores de risco adicionais incluem o número de pólipos removidos, terapia recente com varfarina, pólipos retirados do lado direito do cólon e histologia de pólipos (adenoma viloso). O risco de sangramento pós-polipectomia é maior em pacientes com trombocitopenia ou coagulopatias.
As sociedades de coloproctologia e endoscopia recomendam diretrizes práticas para otimizar a eficácia e a segurança da polipectomia de rotina. Quando a colonoscopia é realizada por um não especialista (coloproctologista ou endoscopista) as complicações comuns são mais frequentes e a perda de lesões e pólipos são maiores impactando no aumento do diagnóstico dos carcinomas de intervalo, aquele câncer de intestino que surgem entre os intervalos recomendados das colonoscopias.
Estudos relataram que um volume de procedimentos >300 colonoscopias por ano está significativamente associado à diminuição dos riscos de complicações. Colonoscopistas com alto volume de exames têm um papel significativo no treinamento de novos profissionais.
Quase todos os sangramentos são complicações da retirada de pólipos (polipectomia ou mucosectomia). Sangramento após uma colonoscopia diagnóstica é muito raro e se ocorrer, geralmente está associado à biópsia. Isso pode ocorrer quando a estrutura do vaso sanguíneo é biopsiada diretamente, especialmente em pacientes com alteração na coagulação do sangue. Também raramente é visto em casos de fricção mecânica severa pelo colonoscópio.
Apesar dos procedimentos mais frequentes e desafiadores, existe uma tendência estabilizadora para “perfurações” e “mortalidade” e uma taxa decrescente de “sangramento” pós-colonoscopia. Esses resultados são provavelmente devido ao avanço tecnológico dos equipamentos para colonoscopia, melhora da técnica de realização da colonoscopia e retirada de pólipos e especialmente na evolução da formação e treinamento do colonoscopista.
A incidência geral do sangramento varia de 1 a 6 por 1.000 colonoscopias com retirada de pólipos. O tamanho do pólipo é relatado como o fator de risco mais relevante para o sangramento pós-polipectomia. Fatores de risco adicionais incluem o número de pólipos removidos, terapia recente com varfarina, pólipos retirados do lado direito do cólon e histologia de pólipos (adenoma viloso). O risco de sangramento pós-polipectomia é maior em pacientes com trombocitopenia ou coagulopatias.
As sociedades de coloproctologia e endoscopia recomendam diretrizes práticas para otimizar a eficácia e a segurança da polipectomia de rotina. Quando a colonoscopia é realizada por um não especialista (coloproctologista ou endoscopista) as complicações comuns são mais frequentes e a perda de lesões e pólipos são maiores impactando no aumento do diagnóstico dos carcinomas de intervalo, aquele câncer de intestino que surgem entre os intervalos recomendados das colonoscopias.
Estudos relataram que um volume de procedimentos >300 colonoscopias por ano está significativamente associado à diminuição dos riscos de complicações. Colonoscopistas com alto volume de exames têm um papel significativo no treinamento de novos profissionais.
Quase todos os sangramentos são complicações da retirada de pólipos (polipectomia ou mucosectomia). Sangramento após uma colonoscopia diagnóstica é muito raro e se ocorrer, geralmente está associado à biópsia. Isso pode ocorrer quando a estrutura do vaso sanguíneo é biopsiada diretamente, especialmente em pacientes com alteração na coagulação do sangue. Também raramente é visto em casos de fricção mecânica severa pelo colonoscópio.
Fatores de risco para sangramento pós-polipectomia
Os fatores relacionados ao pólipo incluem: tamanho do pólipo, morfologia do pólipo e localização do pólipo no cólon.
Um dos principais fatores de risco relacionados ao pólipo é o seu tamanho. Em um estudo que investigou a retirada de pólipos pediculados, a taxa de sangramento pós-polipectomia imediato e/ou tardio foi de 3,1% para pólipos de 1 a 1,9 cm, enquanto para pólipos com 2 cm ou mais foi de 15,1%. O aumento do risco de sangramento pós-polipectomia também está associado à morfologia do pólipo, sendo mais frequentes nos pólipos pediculados e lesões de crescimento lateral (LST) com mais de 2 cm. Pólipos localizados no lado direito do cólon também apresentam um risco maior de sangramento. Atenção aos grandes pólipos localizados no cólon direito!!!
Fatores relacionados ao paciente incluem idade acima de 65 anos, história de doença cardiovascular e o uso de agentes antiplaquetários e anticoagulantes.
Um estudo retrospectivo focado especificamente no uso de anticoagulação durante a colonoscopia constatou que o sangramento pós-polipectomia tardio ocorreu em 2,6% dos indivíduos com varfarina interrompida somente para a polipectomia e retornando no dia seguinte em comparação com 0,2% dos indivíduos que não usavam nenhum medicamento anticoagulante. Uma metanálise mostrou que a polipectomia em pacientes usando clopidogrel aumenta significativamente o risco de sangramento pós-polipectomia tardio. Embora tienopiridinas e varfarina aumentam o risco de sangramento pós-polipectomia, é importante lembrar que o risco de sangramento pós-polipectomia não altera em pacientes usando apenas aspirina ou anti-inflamatórios não esteroidais (AINEs) isoladamente.
Fatores relacionados ao médico incluem as técnicas escolhidas para a remoção dos pólipos.
Acredita-se que o uso de alça com eletrocautério (alça quente) em oposição a alça sem cauterização (alça a frio) tenha um risco maior de sangramento pós-polipectomia tardio. Embora isso não tenha sido bem estudado para a remoção de pólipos grandes, várias séries de casos relataram taxas muito baixas de sangramento tardio após a remoção com alça fria. Outra técnica, o uso profilático dos clipes, ganhou popularidade nos últimos anos com o pensamento que a colocação rotineira de clipes após polipectomia, especialmente para pólipos grandes, pode reduzir o risco de sangramento tardio. No entanto, além de um estudo retrospectivo que se mostrou promissor, essa prática ainda não foi confirmada como benéfica em ensaios randomizados.
Um dos principais fatores de risco relacionados ao pólipo é o seu tamanho. Em um estudo que investigou a retirada de pólipos pediculados, a taxa de sangramento pós-polipectomia imediato e/ou tardio foi de 3,1% para pólipos de 1 a 1,9 cm, enquanto para pólipos com 2 cm ou mais foi de 15,1%. O aumento do risco de sangramento pós-polipectomia também está associado à morfologia do pólipo, sendo mais frequentes nos pólipos pediculados e lesões de crescimento lateral (LST) com mais de 2 cm. Pólipos localizados no lado direito do cólon também apresentam um risco maior de sangramento. Atenção aos grandes pólipos localizados no cólon direito!!!
Fatores relacionados ao paciente incluem idade acima de 65 anos, história de doença cardiovascular e o uso de agentes antiplaquetários e anticoagulantes.
Um estudo retrospectivo focado especificamente no uso de anticoagulação durante a colonoscopia constatou que o sangramento pós-polipectomia tardio ocorreu em 2,6% dos indivíduos com varfarina interrompida somente para a polipectomia e retornando no dia seguinte em comparação com 0,2% dos indivíduos que não usavam nenhum medicamento anticoagulante. Uma metanálise mostrou que a polipectomia em pacientes usando clopidogrel aumenta significativamente o risco de sangramento pós-polipectomia tardio. Embora tienopiridinas e varfarina aumentam o risco de sangramento pós-polipectomia, é importante lembrar que o risco de sangramento pós-polipectomia não altera em pacientes usando apenas aspirina ou anti-inflamatórios não esteroidais (AINEs) isoladamente.
Fatores relacionados ao médico incluem as técnicas escolhidas para a remoção dos pólipos.
Acredita-se que o uso de alça com eletrocautério (alça quente) em oposição a alça sem cauterização (alça a frio) tenha um risco maior de sangramento pós-polipectomia tardio. Embora isso não tenha sido bem estudado para a remoção de pólipos grandes, várias séries de casos relataram taxas muito baixas de sangramento tardio após a remoção com alça fria. Outra técnica, o uso profilático dos clipes, ganhou popularidade nos últimos anos com o pensamento que a colocação rotineira de clipes após polipectomia, especialmente para pólipos grandes, pode reduzir o risco de sangramento tardio. No entanto, além de um estudo retrospectivo que se mostrou promissor, essa prática ainda não foi confirmada como benéfica em ensaios randomizados.
Estratificação do risco de sangramento pós-polipectomia
O risco de sangramento após a retirada de pólipos é estratificado e classificado em duas categorias.
- Procedimentos de baixo risco que inclui a colonoscopia diagnóstica com ou sem biópsia de mucosa.
- Procedimentos de alto risco que incluem a colonoscopia com polipectomia e dilatação de estenoses colônicas benignas ou malignas.
Técnicas endoscópicas para prevenir o sangramento pós-polipectomia
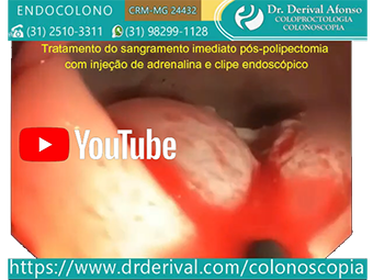
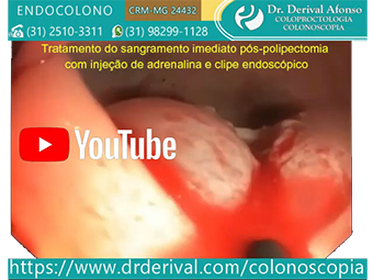
Algumas técnicas endoscópicas foram desenvolvidas para prevenir o sangramento pós-polipectomia como a injeção submucosa de solução de adrenalina diluída (1:10.000) na base de qualquer pólipo e dispositivos mecânicos com clipe endoscópico ou endoloop (alça de náilon destacável).
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
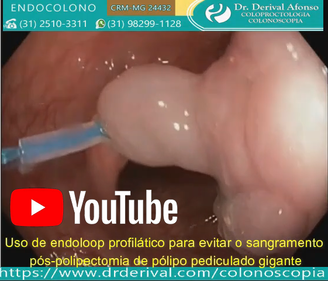
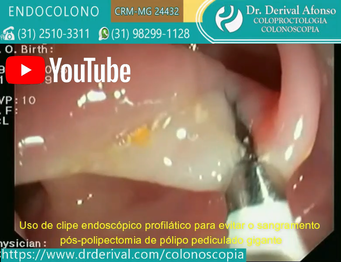
A eficácia dos dispositivos mecânicos (endoloop ou clipe endoscópico) para prevenir o sangramento pós-polipectomia por meio de sua fixação no pedículo do pólipo ou fechamento do defeito da mucosa foi bem estabelecida. No entanto, estudos randomizados controlados não conseguiram demonstrar a eficácia dos clipes na prevenção do sangramento pós-polipectomia tardio. Ambos são usados isoladamente ou em combinação com injeção de adrenalina na base do pedículo.
O endoloop é colocado no pedículo do pólipo da mesma maneira que uma alça de polipectomia, mas depois de apertado é solto ao redor do pedículo. No entanto, existem problemas com os endoloops, como, por ser flexíveis, ter dificuldade em laçar o pólipo ou estrangular adequadamente, quando o sangramento imediato pode ocorrer. Sendo assim, o corte do pólipo com o eletrocautério deve ser realizado alguns minutos após o endolop ser apertado, tempo necessário para que o endoscopista perceba a alteração da cor da cabeça do pólipo de vermelho vivo para violáceo, demostrando diminuição significativa do fluxo de sangue.
O endoloop é colocado no pedículo do pólipo da mesma maneira que uma alça de polipectomia, mas depois de apertado é solto ao redor do pedículo. No entanto, existem problemas com os endoloops, como, por ser flexíveis, ter dificuldade em laçar o pólipo ou estrangular adequadamente, quando o sangramento imediato pode ocorrer. Sendo assim, o corte do pólipo com o eletrocautério deve ser realizado alguns minutos após o endolop ser apertado, tempo necessário para que o endoscopista perceba a alteração da cor da cabeça do pólipo de vermelho vivo para violáceo, demostrando diminuição significativa do fluxo de sangue.
Um ou mais clipes endoscópicos são colocados na base do pedículo imediatamente antes da polipectomia. A principal vantagem dessa abordagem é que os clipes endoscópicos geralmente são fáceis de colocar. As desvantagens incluem a frequente necessidade de usar vários clipes nos pedículos muito grandes e, de fato, pode ser inviável quando os clipes endoscópicos podem não ter tamanho suficiente para pegar todo o pedículo, mesmo quando vários clipes são aplicados. Outra desvantagem é o processo inflamatório que pode surgir em torno dos clipes que não caem dificultando a diferenciação com pólipo residual nas colonoscopias de controle.
Sangramento pós-polipectomia imediato e tardio
O sangramento imediato é definido como aquele que ocorre nas primeiras 24 horas após a colonoscopia e o sangramento tardio como aquele que ocorre de 24 horas a 14 dias após a colonoscopia.
O sangramento pós-polipectomia imediato é aquele reconhecido durante o procedimento, quando normalmente pode ser tratado imediatamente usando técnicas de hemostasia endoscópica como: injeção de adrenalina, clipes, ligaduras e cautério ou dentro das primeiras 24 horas pós procedimento, quando pode ser controlado por nova colonoscopia sem preparo, já que o sangue é laxante. Geralmente o local do sangramento é facilmente identificado nesta nova colonoscopia, porque foi descrito anatomicamente no exame anterior, quando então, pode ser tratada endoscopicamente.
O mecanismo de sangramento pós-polipectomia imediato varia de acordo com a morfologia do pólipo. No caso de pólipos pediculados um grande vaso de alimentação passa pelo pedículo e uma eletrocoagulação insuficiente durante o corte do pedículo com alça pode causar sangramento arterial em jato. No caso de pólipos sésseis um corte profundo e amplo pode resultar em eletrocoagulação insuficiente e resultar em sangramento no leito da lesão.
O sangramento pós-polipectomia tardio é tipicamente observado cinco a sete dias após o procedimento, mas pode ocorrer no período de até quatro semanas. Existem duas causas principais para sangramento pós-polipectomia tardio:
1- Devido à descamação da escara ou crosta que cobria um vaso sanguíneo. A descamação da crosta é uma parte normal do processo de cicatrização e pode ser espontânea ou relacionada à passagem de fezes pela sua superfície;
2- Devido ao aumento da área de necrose causada pela cauterização utilizada para ressecar o pólipo e cauterizar o local da polipectomia. Durante os primeiros dias após o procedimento, a área de necrose aumenta até o nível do tecido não lesado, e geralmente é mais profunda em comparação com o que é visualizado no momento da polipectomia. A necrose geralmente envolve algum grau da submucosa, o que pode levar à hemorragia caso se estenda para um vaso sanguíneo. ou devido à extensão da área de necrose térmica.
Os pacientes podem apresentar enterorragia ou hematoquezia (sangue vivo ou marrom) ou melena (sangue escuro), dependendo da localização e intensidade do sangramento (o sangramento do cólon direito pode se apresentar como melena). Alguns pacientes apresentam sinais de hipovolemia, como taquicardia ou hipotensão, embora muitos pacientes permaneçam hemodinamicamente estáveis. A hemoglobina inicial em pacientes com sangramento agudo pós-polipectomia normalmente estará na linha de base do paciente. Em 24 horas ou mais após a apresentação, a hemoglobina refletirá a quantidade de perda de sangue. O sangramento tardio pós-polipectomia é considerado clinicamente importante se resultar em hospitalização ou transfusão de sangue, ou se uma colonoscopia ou cirurgia seja realizada para tratar o local do sangramento.
A grande maioria dos sangramentos imediatos ou tardios podem ser controlados com segurança pela colonoscopia com várias técnicas hemostáticas, incluindo a colocação de clipes. Assim, o tratamento cirúrgico raramente é necessário.
O sangramento pós-polipectomia imediato é aquele reconhecido durante o procedimento, quando normalmente pode ser tratado imediatamente usando técnicas de hemostasia endoscópica como: injeção de adrenalina, clipes, ligaduras e cautério ou dentro das primeiras 24 horas pós procedimento, quando pode ser controlado por nova colonoscopia sem preparo, já que o sangue é laxante. Geralmente o local do sangramento é facilmente identificado nesta nova colonoscopia, porque foi descrito anatomicamente no exame anterior, quando então, pode ser tratada endoscopicamente.
O mecanismo de sangramento pós-polipectomia imediato varia de acordo com a morfologia do pólipo. No caso de pólipos pediculados um grande vaso de alimentação passa pelo pedículo e uma eletrocoagulação insuficiente durante o corte do pedículo com alça pode causar sangramento arterial em jato. No caso de pólipos sésseis um corte profundo e amplo pode resultar em eletrocoagulação insuficiente e resultar em sangramento no leito da lesão.
O sangramento pós-polipectomia tardio é tipicamente observado cinco a sete dias após o procedimento, mas pode ocorrer no período de até quatro semanas. Existem duas causas principais para sangramento pós-polipectomia tardio:
1- Devido à descamação da escara ou crosta que cobria um vaso sanguíneo. A descamação da crosta é uma parte normal do processo de cicatrização e pode ser espontânea ou relacionada à passagem de fezes pela sua superfície;
2- Devido ao aumento da área de necrose causada pela cauterização utilizada para ressecar o pólipo e cauterizar o local da polipectomia. Durante os primeiros dias após o procedimento, a área de necrose aumenta até o nível do tecido não lesado, e geralmente é mais profunda em comparação com o que é visualizado no momento da polipectomia. A necrose geralmente envolve algum grau da submucosa, o que pode levar à hemorragia caso se estenda para um vaso sanguíneo. ou devido à extensão da área de necrose térmica.
Os pacientes podem apresentar enterorragia ou hematoquezia (sangue vivo ou marrom) ou melena (sangue escuro), dependendo da localização e intensidade do sangramento (o sangramento do cólon direito pode se apresentar como melena). Alguns pacientes apresentam sinais de hipovolemia, como taquicardia ou hipotensão, embora muitos pacientes permaneçam hemodinamicamente estáveis. A hemoglobina inicial em pacientes com sangramento agudo pós-polipectomia normalmente estará na linha de base do paciente. Em 24 horas ou mais após a apresentação, a hemoglobina refletirá a quantidade de perda de sangue. O sangramento tardio pós-polipectomia é considerado clinicamente importante se resultar em hospitalização ou transfusão de sangue, ou se uma colonoscopia ou cirurgia seja realizada para tratar o local do sangramento.
A grande maioria dos sangramentos imediatos ou tardios podem ser controlados com segurança pela colonoscopia com várias técnicas hemostáticas, incluindo a colocação de clipes. Assim, o tratamento cirúrgico raramente é necessário.
Tratamento do sangramento imediato após a retirada de pólipo
Tratamento do sangramento imediato pós-polipectomia
Como eu faço para tratar o sangramento imediato pós-polipectomia?
Tratamento do sangramento imediato pós-polipectomia
Como eu faço para tratar o sangramento imediato pós-polipectomia?
O sangramento imediato pode ser controlado com várias técnicas endoscópicas. A técnica depende da gravidade do sangramento, do tipo de pólipo e da preferência individual. Além disso, pode ser necessária uma combinação de técnicas (por exemplo, injeção de adrenalina diluída e colocação de clipe endoscópico).
Pacientes cujas polipectomias foram realizadas ambulatorialmente podem ser encaminhados para casa após a hemostasia, desde que o paciente tenha permanecido hemodinamicamente estável durante todo o episódio de sangramento e durante o período de observação pós-procedimento.
Pacientes cujas polipectomias foram realizadas ambulatorialmente podem ser encaminhados para casa após a hemostasia, desde que o paciente tenha permanecido hemodinamicamente estável durante todo o episódio de sangramento e durante o período de observação pós-procedimento.
Sangramento após a remoção de pólipo pediculado - Sangramento pós-polipectomia imediato de pólipo pediculado
Para pólipos pediculados, o sangramento imediato pós-polipectomia geralmente é controlado ao laçar o pedículo residual com a alça de polipectomia, mantendo a compressão máxima durante 5 minutos. Isso interrompe o fluxo sanguíneo e geralmente resultará em hemostasia. Se o sangramento voltar ao afrouxar a alça, reaplicar a pressão por mais cinco minutos geralmente resultará na cessação definitiva do sangramento. O corte com cautério do pedículo residual não é uma abordagem recomendada, pois pode não existir pedículo remanescente suficiente para capturar, além de um risco aumentado de perfuração. Uma vez que o sangramento ativo é controlado geralmente não há mais sangramento.
Quando pólipos pediculados são ressecados, mesmo que exista um pedículo longo, o pedículo residual pode retrair rapidamente deixando uma área plano no sítio da polipectomia. O fenômeno do desaparecimento do pedículo pode resultar em uma situação em que não há pedículo remanescente na parede do cólon para ser capturado com uma alça.
Para pacientes com pedículos remanescentes nos quais o sangramento não pôde ser controlado com a manobra de colocação da alça e aqueles em que o pedúnculo residual não pôde ser capturado, medidas adicionais, como colocação de clipe endoscópico, injeção submucosa de adrenalina diluída e coagulação térmica, são usadas para conseguir a hemostasia. Esses métodos adicionais, que também são usados para tratar o sangramento após a remoção de um pólipo séssil, são discutidos abaixo. (Consulte 'Sangramento após a remoção de pólipos sésseis' abaixo.)
Quando pólipos pediculados são ressecados, mesmo que exista um pedículo longo, o pedículo residual pode retrair rapidamente deixando uma área plano no sítio da polipectomia. O fenômeno do desaparecimento do pedículo pode resultar em uma situação em que não há pedículo remanescente na parede do cólon para ser capturado com uma alça.
Para pacientes com pedículos remanescentes nos quais o sangramento não pôde ser controlado com a manobra de colocação da alça e aqueles em que o pedúnculo residual não pôde ser capturado, medidas adicionais, como colocação de clipe endoscópico, injeção submucosa de adrenalina diluída e coagulação térmica, são usadas para conseguir a hemostasia. Esses métodos adicionais, que também são usados para tratar o sangramento após a remoção de um pólipo séssil, são discutidos abaixo. (Consulte 'Sangramento após a remoção de pólipos sésseis' abaixo.)
Sangramento após a remoção de pólipo séssil - Sangramento pós-polipectomia imediato de pólipo séssil
Para pacientes com sangramento após a remoção de um pólipo séssil, o tratamento inicial geralmente é pela colocação de clipe endoscópico ou coagulação térmica. Qualquer uma dessas modalidades pode ser usada como monoterapia ou pode ser combinada com terapia de injeção com adrenalina diluída.
●Adrenalina – A terapia de injeção é normalmente usada em conjunto com outras formas de tratamento, como colocação de clipe endoscópico ou coagulação térmica, embora a terapia de injeção possa ser usada isoladamente em pacientes com sangramento discreto. A adrenalina diluída em solução salina de 1:10.000 a 1:20.000 é injetada na submucosa em volume de 0,5 a 2,0 mL nos quatro quadrantes dentro de 3 mm em torno do local do sangramento. Em pacientes com risco aumentado de ter um evento adverso com injeção de adrenalina, como aqueles com doença cardiovascular, uma diluição de 1:100.000 pode ser usada. O efeito terapêutico das injeções é o tamponamento local no sítio do sangramento e o espasmo do vaso sangrante induzido pela adrenalina.
●Adrenalina – A terapia de injeção é normalmente usada em conjunto com outras formas de tratamento, como colocação de clipe endoscópico ou coagulação térmica, embora a terapia de injeção possa ser usada isoladamente em pacientes com sangramento discreto. A adrenalina diluída em solução salina de 1:10.000 a 1:20.000 é injetada na submucosa em volume de 0,5 a 2,0 mL nos quatro quadrantes dentro de 3 mm em torno do local do sangramento. Em pacientes com risco aumentado de ter um evento adverso com injeção de adrenalina, como aqueles com doença cardiovascular, uma diluição de 1:100.000 pode ser usada. O efeito terapêutico das injeções é o tamponamento local no sítio do sangramento e o espasmo do vaso sangrante induzido pela adrenalina.
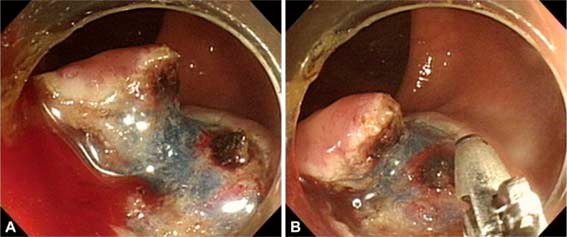
●Clipes endoscópicos – O clipe endoscópico é uma importante opção na hemostasia e tratamento do sangramento imediato pós-polipectomia. Para sangramento no local de remoção de um pólipo séssil (ou seja, local plano), o clipe endoscópico é aplicado primeiro diretamente no ponto do sangramento. Após o controle da hemorragia, clipes adicionais podem ser colocados em ambos os lados do clipe inicial para ocluir o vaso de alimentação ou ser usados para fechar o defeito da mucosa, se for grande ou continuar o sangramento em lençol. Para pólipos pediculados os clipes endoscópicos são aplicados diretamente no pedículo residual.
●Coagulação térmica – A aplicação de coagulação térmica no local do sangramento resulta em hemostasia, e normalmente é realizada com uma sonda de contato, como a sonda de eletrocoagulação bipolar (BICAP) ou a ponta de uma alça de polipectomia. Quando uma sonda bipolar é usada, a corrente fornecida deve ser reduzida em aproximadamente 50% (cerca de 10 watts) em relação àquela usada para úlceras hemorrágicas no trato gastrointestinal superior, porque a parede do cólon é muito fina e mais suscetível à perfuração. Quando a ponta da alça de polipectomia é usada, a corrente deve ser ajustada para o modo de coagulação. Para qualquer modalidade térmica recomenda-se que a duração de cada aplicação seja de um a dois segundos. Jato de água através da sonda é extremamente útil para limpar o sangue do local e permitir a localização precisa para usar a sonda.
|
Outra técnica de coagulação térmica é o uso de pinças de coagulação que agarram diretamente o vaso e aplicam uma corrente de coagulação suave. Essa técnica, que utiliza corrente monopolar, é comumente usada para controlar o sangramento na dissecção endoscópica da submucosa (ESD). O vaso sangrante é agarrado com a pinça, "puxado" em direção ao aparelho e uma leve coagulação é aplicada em rajadas curtas de um a dois segundos.
|
●Outros métodos – Outros métodos para a hemostasia do local do sangramento pós-polipectomia imediato incluem coagulação com plasma de argônio (APC) e ligadura elástica. O sangramento em lençol no local da polipectomia após a remoção de um pólipo séssil grande (≥2 cm) pode ser controlada com coagulação com plasma de argônio.
Tratamento do sangramento tardio após a retirada de pólipo
Tratamento do sangramento tardio pós-polipectomia
Como eu faço para tratar o sangramento tardio pós-polipectomia?
Tratamento do sangramento tardio pós-polipectomia
Como eu faço para tratar o sangramento tardio pós-polipectomia?
Pacientes sem sangramento contínuo pós-polipectomia
Para pacientes com pequeno volume de sangue nas fezes (ou seja, < 50mL) ou param de evacuar sangue após a apresentação inicial, geralmente é seguro adiar a colonoscopia enquanto continua o monitoramento clínico (por exemplo, frequência cardíaca, pressão arterial, níveis seriados de hemoglobina, evacuações).
Se o sangramento parou sem intervenção endoscópica, é incomum que volte. Como resultado, não há necessidade de repetir a colonoscopia para avaliar o local presumido de sangramento em um paciente cujo sangramento parou.
Se ocorrerem evacuações sanguinolentas durante este período de observação, o paciente deve fazer a colonoscopia após o preparo intestinal.
Para pacientes com pequeno volume de sangue nas fezes (ou seja, < 50mL) ou param de evacuar sangue após a apresentação inicial, geralmente é seguro adiar a colonoscopia enquanto continua o monitoramento clínico (por exemplo, frequência cardíaca, pressão arterial, níveis seriados de hemoglobina, evacuações).
Se o sangramento parou sem intervenção endoscópica, é incomum que volte. Como resultado, não há necessidade de repetir a colonoscopia para avaliar o local presumido de sangramento em um paciente cujo sangramento parou.
Se ocorrerem evacuações sanguinolentas durante este período de observação, o paciente deve fazer a colonoscopia após o preparo intestinal.
Pacientes com sangramento tardio contínuo pós-polipectomia
A avaliação inicial e o manejo de um paciente com suspeita de sangramento pós-polipectomia tardio são semelhantes à abordagem para pacientes com sangramento gastrointestinal inferior (GI) de outras fontes. Os pacientes devem ser avaliados imediatamente.
Sinais de hipovolemia (taquicardia – FC > 100 bpm, hipotensão postural, sudorese e desmaio) são sugestivos de instabilidade hemodinâmica, e os exames laboratoriais iniciais incluem hemograma completo, bioquímica sérica (função renal – ureia e creatinina, função hepática – gamaGT, TGO e TGP, eletrólitos – K, Ca e Na) e estudos de coagulação. A avaliação do coloproctologista ou endoscopista deve ser obtida no momento da admissão do paciente. A avaliação e o manejo de pacientes com sangramento do trato gastrointestinal inferior, incluindo avaliação clínica, ressuscitação volêmica, transfusão de sangue e tratamento de coagulopatias, são discutidos separadamente.
Para pacientes com sangramento grave pós-polipectomia resultando em instabilidade hemodinâmica (ou seja, taquicardia e/ou hipotensão que não responde à ressuscitação com fluidos ou sangue), a avaliação do cirurgião deve ser solicitada prontamente para uma abordagem multidisciplinar e intervenções adicionais.
Sinais de hipovolemia (taquicardia – FC > 100 bpm, hipotensão postural, sudorese e desmaio) são sugestivos de instabilidade hemodinâmica, e os exames laboratoriais iniciais incluem hemograma completo, bioquímica sérica (função renal – ureia e creatinina, função hepática – gamaGT, TGO e TGP, eletrólitos – K, Ca e Na) e estudos de coagulação. A avaliação do coloproctologista ou endoscopista deve ser obtida no momento da admissão do paciente. A avaliação e o manejo de pacientes com sangramento do trato gastrointestinal inferior, incluindo avaliação clínica, ressuscitação volêmica, transfusão de sangue e tratamento de coagulopatias, são discutidos separadamente.
Para pacientes com sangramento grave pós-polipectomia resultando em instabilidade hemodinâmica (ou seja, taquicardia e/ou hipotensão que não responde à ressuscitação com fluidos ou sangue), a avaliação do cirurgião deve ser solicitada prontamente para uma abordagem multidisciplinar e intervenções adicionais.
Colonoscopia nos pacientes com sangramento tardio contínuo pós-polipectomia
Os pacientes com sangramento contínuo devem ser submetidos à colonoscopia após a ressuscitação e preparo intestinal (normalmente dentro de 24 horas após a admissão), enquanto os pacientes que param de sangrar não precisam da colonoscopia.
Com base na experiência clínica, a frequência com que os pacientes evacuam com sangue é um bom indicador da continuidade do sangramento. As evacuações sanguinolentas que são frequentes (ou seja, ocorrem a cada duas horas) sugerem sangramento ativo, enquanto a cessação do sangramento no local da polipectomia é marcada pela redução progressiva das evacuações sanguinolentas até a parada completa.
Para pacientes hospitalizados com sangramento pós-polipectomia em curso, a preparo intestinal é o mesmo usado para a colonoscopia eletiva iniciando 6 horas antes do exame, embora o sangue dentro da luz do cólon tenha um efeito laxante e possa ajudar no preparo do intestino para o exame.
O cenário ideal para uma colonoscopia de urgência é quando a equipe regular de endoscopia está presente, e isso geralmente ocorre durante o horário habitual de funcionamento da unidade de endoscopia. Por exemplo, se um paciente apresenta sangramento pós-polipectomia à noite ou nas primeiras horas da manhã, primeiro o paciente é estabilizado para depois realizar o preparo intestinal e quando completo a colonoscopia é realizada. O paciente é monitorado durante todo o tempo.
Tratamento endoscópico do tratamento do sangramento pós-polipectomia tardio
A maioria dos pacientes com sangramento pós-polipectomia tardio ativo pode ser tratada com terapia endoscópica e raramente requer intervenção adicional, como cirurgia ou métodos angiográficos (por exemplo, embolização seletiva).
A terapia endoscópica é realizada com a colocação de clipes endoscópicos ou uma modalidade térmica (por exemplo, eletrocautério bipolar), às vezes em combinação com injeção submucosa de adrenalina, conforme discutido anteriormente. Para minimizar potenciais novas lesões da mucosa pela eletrocauterização, normalmente usa-se clipes endoscópicos para controlar o sangramento no local da polipectomia quando a colocação do clipe é tecnicamente viável como descrito acima em sangramento após a remoção do pólipo séssil acima.
A injeção submucosa de adrenalina diluída (1:10.000) é menos eficaz em pacientes com sangramento tardio, em contraste com a injeção no sangramento pós-polipectomia imediato. Porque a resposta inflamatória causa um grau leve a moderado de edema e endurecimento no local da polipectomia dentro de um a dois dias. Isso pode impedir a distensão da submucosa e resultar na incapacidade da solução de adrenalina se infiltrar nos espaços teciduais, fazendo com que a solução líquida injetada escorra pelo orifício da agulha no local da injeção. Por outro lado, o endurecimento e o consequente aumento da espessura da parede do cólon podem tornar o uso de modalidades térmicas mais seguras, de modo que aplicações repetidas da sonda bipolar ou pinça coagulante podem ser usadas para a hemostasia com menos risco de perfuração.
Tratamento do sangramento pós-polipectomia que não responde às medidas endoscópicas
Outras opções incluem terapia angiográfica (por exemplo, embolização seletiva) e cirurgia para remover a porção do cólon que contém o local da polipectomia.
A terapia angiográfica é preferível à cirurgia para pacientes com hemorragia não controlada porque é eficaz, e menos invasiva. A embolização arterial transcateter superseletiva com micromolas tem sido eficaz no controle do sangramento refratário à terapia endoscópica em relatos de casos.
A cirurgia pode ser necessária em pacientes com sangramento persistente após a tentativa do tratamento endoscópico e outras intervenções falham ou não estejam disponíveis. Se apenas um pólipo foi removido, o local do sangramento é identificado pela tatuagem com nanquim realizada na colonoscopia de urgência nos casos em que não se consegue controlar o sangramento por métodos endoscópicos.
Uma colectomia subtotal pode ser necessária se vários pólipos forem removidos em várias áreas do cólon e um exame colonoscópico não puder identificar o local do sangramento da polipectomia.
Resultados do tratamento de pacientes com sangramento pós-polipectomia tardio
Felizmente, para os pacientes que apresentam sangramento pós-polipectomia, essa complicação geralmente não está associada a nenhuma sequela importante a longo prazo. Em um estudo de 1.657 indivíduos submetidos à polipectomia, houve 5 com sangramento pós-polipectomia tardio, todos os quais receberam transfusão de sangue. Todos foram tratados com sucesso por nova colonoscopia. Nenhum desses indivíduos necessitou de cirurgia e nenhum morreu.
Considerações ao encaminhar pacientes com doenças cardiovasculares para colonoscopia
Ao encaminhar pacientes para colonoscopia, é muito importante avaliar cuidadosamente o uso de agentes antiplaquetários ou anticoagulantes e o momento da colonoscopia. O uso de agentes antiplaquetários e anticoagulantes está aumentando devido às altas taxas de doença arterial coronariana e doença cerebrovascular. Ao considerar uma colonoscopia, os riscos de suspender esses medicamentos e, portanto, precipitar eventos trombóticos, devem ser cuidadosamente ponderados em relação aos riscos de continuar esses agentes durante procedimentos endoscópicos que pode ser complicado por sangramento, particularmente procedimentos com intervenções de alto risco de sangramento, como polipectomia.
Além disso, quando o tratamento com agentes que aumentam o risco de sangramento é de curta duração, os procedimentos eletivos devem ser adiados até que a terapia seja concluída. Também deve-se ter em mente que, embora a polipectomia apresente risco de hemorragia, muitos dos pacientes que estão sendo submetidos à colonoscopia para rastreamento ou vigilância do câncer de cólon não precisarão de polipectomia durante a colonoscopia; no entanto, isso não é conhecido até que o procedimento seja concluído. Ao considerar a endoscopia para pacientes em uso de anticoagulantes, várias questões importantes devem ser ponderadas.
Questões a serem consideradas ao avaliar um paciente em uso de agentes anticoagulantes ou antiplaquetários para colonoscopia.
Gerenciamento da ASPIRINA durante a colonoscopia
A aspirina inativa irreversivelmente as plaquetas durante sua vida útil, de 7 a 10 dias. No entanto, com base em vários estudos retrospectivos, as diretrizes concordam que a aspirina pode ser continuada com segurança durante a colonoscopia com polipectomia sem preocupação com um aumento significativo do sangramento. Além disso, os riscos cardiovasculares associados à retirada da aspirina podem ser altos, especialmente em pacientes com história de doença arterial coronariana.
Gerenciamento das TIENOPIRIDINAS (clopidogrel) durante a colonoscopia
As tienopiridinas inibem a função plaquetária. Em pacientes com doença arterial coronariana, especialmente no contexto de stents coronários. As tienopiridinas são mais frequentemente administradas em combinação com aspirina, que é denominada terapia antiplaquetária dupla (DAPT).
Pacientes usando tienopiridinas durante a polipectomia apresentam uma taxa de sangramento pós-polipectomia significativamente maior (2,4%) quando comparados aos demais pacientes (0,3 a 1,2%). O risco é ainda maior quando as tienopiridina estão associadas à aspirina.
Embora o sangramento pós-polipectomia seja uma complicação que possa ser evitada com a suspenção das tienopiridinas, é importante notar que essa complicação tem baixa mortalidade associada, porque geralmente é tratada sem cirurgia e não tem consequências a longo prazo. Portanto, deve-se considerar sempre o risco de eventos tromboembólicos relacionados à retirada de agentes antiplaquetários, incluindo trombose de stent.
As diretrizes de 2016 da American Society for Gastrointestinal Endoscopy (ASGE) recomendam, em geral, a interrupção das tienopiridinas e a manutenção da aspirina para os procedimentos colonoscópicos planejados com alto risco de sangramento, como a polipectomia. No entanto, para pessoas com alto risco de tromboembolismo, deve-se considerar adiar o procedimento colonoscópico até que o risco de descontinuação das tienopiridinas seja menor (por exemplo, esperar até 12 meses após a colocação de um stent coronário farmacológico). Além disso, a urgência do procedimento deve ser ponderada. Por exemplo, adiar a colonoscopia de triagem ou vigilância por no mínimo 12 meses, mas reduzir para 6 meses para um paciente assintomático com anemia por deficiência ferro.
Também deve ser considerada a realização da colonoscopia sem suspender as tienopiridinas após uma cuidadosa ponderação de riscos e benefícios se houver alta urgência para o procedimento. Além disso, para procedimentos endoscópicos considerados de baixo risco de sangramento (por exemplo, colonoscopia diagnóstica para avaliar anemia ferropriva sem plano de polipectomia), a recomendação da ASGE é continuar os agentes durante o procedimento.
Se o adiamento da colonoscopia for considerado desaconselhável, o risco de tromboembolismo não for alto e o procedimento planejado for de alto risco de sangramento, a tienopiridina deve ser descontinuada 5 a 7 dias antes do procedimento. Mas se o risco de tromboembolismo for aumentado recomenda-se o uso de heparina de baixo peso molecular subcutânea como ponte durante os dias de suspensão das tienopiridinas, interrompendo 24 horas antes do exame.
Gerenciamento da Varfarina durante a colonoscopia
A varfarina é um agente anticoagulante comumente usado para o tratamento de uma variedade de distúrbios, incluindo trombose venosa profunda (TVP); embolia pulmonar; acidente vascular cerebral isquêmico; e profilaxia de tromboembolismo arterial de fibrilação atrial, flutter e distúrbios valvulares cardíacos.
É importante lembrar que, embora o objetivo de interromper os anticoagulantes periprocedimento seja reduzir o risco de sangramento, os pacientes que estão em terapia com varfarina ainda apresentam risco aumentado de sangramento pós-procedimento, apesar da retirada do medicamento antes do exame como recomendado.
Um estudo retrospectivo comparou o sangramento pós-polipectomia tardio em indivíduos que interromperam a varfarina com indivíduos que não estavam em uso de varfarina e encontrou taxas significativamente mais altas de sangramento naqueles que usaram varfarina apesar de ter sido retirada para os exames.
Semelhante às recomendações da ASGE para agentes antiplaquetários, a decisão de retirar ou continuar a varfarina durante a colonoscopia baseia-se na avaliação do risco de sangramento do procedimento planejado, o risco de tromboembolismo se a droga for suspensa e a urgência do procedimento. Se o procedimento for de baixo risco de sangramento (p. colonoscopia diagnóstica sem plano de polipectomia), a varfarina pode ser continuada durante o procedimento. Especificamente, a biópsia da mucosa é segura para ser realizada durante a colonoscopia para pacientes em uso de varfarina cuja razão normalizada internacional está na faixa terapêutica (RNI-alvo de 2,0 e 3,0).
No entanto, as diretrizes atuais recomendam que, para procedimentos de alto risco como a polipectomia, a varfarina deve ser interrompida 5 dias antes do exame. Quando é tomada a decisão de descontinuar a varfarina, o risco de tromboembolismo deve ser ponderado na decisão de fazer ou não ponte da varfarina com um anticoagulante de ação curta, como a heparina de baixo peso molecular. Para condições de alto risco de tromboembólico, deve-se considerar adiar o procedimento, principalmente se a duração do tratamento do anticoagulante pode ser alcançada em breve (por exemplo, 6 meses de varfarina para um TVP). Se o adiamento for considerado desaconselhável e o risco de tromboembolismo for alto, a varfarina deve ser descontinuada e iniciada a ponte com heparina de baixo peso molecular e retirada no dia anterior ao procedimento (ou seja, última dose 24 horas antes do procedimento).
Gerenciamento de anticoagulantes orais de ação direta durante a colonoscopia
Os anticoagulantes orais diretos (DOACs) são uma nova classe de anticoagulantes que inibem diretamente a trombina. Dabigatrana - (Pradaxa®) ou o fator Xa Rivaroxabana (Xarelto®), Apixabana (Eliquis®) e Edoxabana (Lixiana®) na cascata da coagulação.
As principais vantagens dos DOACs em relação à varfarina é que não necessitam de monitoramento com exames de sangue, menos interações com a dieta e outros medicamentos e início e eliminação mais rápidos da ação (com função renal normal).
Por outro lado, esses agentes são mais caros que a varfarina e, com a exceção da dabigatrana, não há meios disponíveis para reverter o efeito anticoagulante em caso de sangramento. Semelhante à varfarina, os DOACs aumentam o risco de sangramento de todas as causas. Não relacionado à polipectomia, a taxa de sangramento gastrointestinal (GI) foi maior para indivíduos tratados com dabigatrana (3% vs 2%), rivaroxabana (3,2% vs 2,2%) ou edoxabana (1,5% vs 1,2%) em comparação com indivíduos que tomam varfarina.
A razão para o risco aumento de sangramento GI com os DOACs não é claro. Nenhum estudo explorou especificamente taxas de sangramento com procedimentos endoscópicos de alto risco, como polipectomia; no entanto, um pequeno estudo japonês descobriu que a biópsia endoscópica da mucosa parece ser segura para pacientes em uso de dabigatrana.
As diretrizes mais recentes da ASGE (2016) incluíram recomendações sobre a gestão dos DOACs nos exames endoscópicos. Tal como acontece com outros agentes antiplaquetários e anticoagulantes, para procedimentos com baixo risco de sangramento, os DOACs provavelmente podem ser mantidos com segurança. Para procedimentos com alto risco de sangramento, como a polipectomia, os DOACs devem ser retirados antes do exame. Dado o rápido início e eliminação (com função renal normal) desses agentes, não há necessidade de ponte periprocedimento. As diretrizes recomendam manter esses agentes por 2 a 3 meias-vidas antes do procedimento (1 a 2 dias). Para pacientes com doença renal leve a moderada (clearance de creatinina <50 mL/min), o medicamento deve ser retirado 3 a 5 dias antes do procedimento. Geralmente, após o procedimento, o agente pode ser readministrado imediatamente ou dentro de vários dias, dependendo do risco de sangramento para a intervenção que foi realizada.
Quando readministrar as drogas anticoagulantes após o procedimento
Após tomar a decisão de descontinuar um antiplaquetário ou anticoagulante em preparação para um procedimento endoscópico, a próxima decisão importante é quando readministrar o medicamento após o procedimento. Infelizmente, as diretrizes não fornecem um consenso claro porque há muitos poucos estudos para basear as recomendações.
Para tienopiridinas, o ACC/ACG (diretrizes conjuntas do American College of Cardiology e American College of Gastroenterology) recomendam a readministração “assim que possível”, a ASGE recomenda o tempo com base na ponderação dos riscos de doença tromboembólica com a suspensão da medicação e os riscos de sangramento com base no procedimento realizado com readministração imediata, e a Sociedade Britânica de Gastroenterologia recomenda a readministração no dia seguinte ao procedimento. Todas essas recomendações são baseadas em opinião porque não há dados definitivos para orientar essas decisões.
Ao readministrar uma tienopiridina, outra questão controversa é se existe a necessidade de uma dose de ataque da droga (para obter níveis terapêuticos mais rápidos). Ao readministrar o clopidogrel em sua dose oral usual (75 mg ao dia), leva de 5 a 10 dias para atingir inibição plaquetária máxima, em comparação com 12 a 15 horas se o paciente receber 300 a 600 mg. A diretriz do JACC/ACG recomenda que a decisão quanto à necessidade da dose de ataque baseia-se no risco de doença tromboembólicos.
Para pacientes que estavam em uso de varfarina sem ponte, as diretrizes da ASGE recomendam a readministração da varfarina em 24 horas. Para os pacientes que estavam em varfarina que foi ponteada, a varfarina deve ser readministrada na noite do procedimento, enquanto a heparina deve ser retomada o mais rápido possível após o procedimento e retirada assim que o RNI se tornar terapêutico. No entanto, o ajuste dessas diretrizes deve ser caso a caso no cenário de procedimentos de alto risco de sangramento, como grandes polipectomias, porque mesmo a reintrodução da varfarina após 7 dias da polipectomia é fator de risco para sangramento pós-polipectomia tardio.
Para pacientes em uso de DOACs, a ASGE recomenda que esses agentes também sejam readministrados o mais rápido possível. Nos casos em que não podem ser readministrados dentro de 24 horas devido à preocupação com alto risco de sangramento, deve-se considerar a ponte com heparina para aqueles com alto risco tromboembólico.
Com base na experiência clínica, a frequência com que os pacientes evacuam com sangue é um bom indicador da continuidade do sangramento. As evacuações sanguinolentas que são frequentes (ou seja, ocorrem a cada duas horas) sugerem sangramento ativo, enquanto a cessação do sangramento no local da polipectomia é marcada pela redução progressiva das evacuações sanguinolentas até a parada completa.
Para pacientes hospitalizados com sangramento pós-polipectomia em curso, a preparo intestinal é o mesmo usado para a colonoscopia eletiva iniciando 6 horas antes do exame, embora o sangue dentro da luz do cólon tenha um efeito laxante e possa ajudar no preparo do intestino para o exame.
O cenário ideal para uma colonoscopia de urgência é quando a equipe regular de endoscopia está presente, e isso geralmente ocorre durante o horário habitual de funcionamento da unidade de endoscopia. Por exemplo, se um paciente apresenta sangramento pós-polipectomia à noite ou nas primeiras horas da manhã, primeiro o paciente é estabilizado para depois realizar o preparo intestinal e quando completo a colonoscopia é realizada. O paciente é monitorado durante todo o tempo.
Tratamento endoscópico do tratamento do sangramento pós-polipectomia tardio
A maioria dos pacientes com sangramento pós-polipectomia tardio ativo pode ser tratada com terapia endoscópica e raramente requer intervenção adicional, como cirurgia ou métodos angiográficos (por exemplo, embolização seletiva).
A terapia endoscópica é realizada com a colocação de clipes endoscópicos ou uma modalidade térmica (por exemplo, eletrocautério bipolar), às vezes em combinação com injeção submucosa de adrenalina, conforme discutido anteriormente. Para minimizar potenciais novas lesões da mucosa pela eletrocauterização, normalmente usa-se clipes endoscópicos para controlar o sangramento no local da polipectomia quando a colocação do clipe é tecnicamente viável como descrito acima em sangramento após a remoção do pólipo séssil acima.
A injeção submucosa de adrenalina diluída (1:10.000) é menos eficaz em pacientes com sangramento tardio, em contraste com a injeção no sangramento pós-polipectomia imediato. Porque a resposta inflamatória causa um grau leve a moderado de edema e endurecimento no local da polipectomia dentro de um a dois dias. Isso pode impedir a distensão da submucosa e resultar na incapacidade da solução de adrenalina se infiltrar nos espaços teciduais, fazendo com que a solução líquida injetada escorra pelo orifício da agulha no local da injeção. Por outro lado, o endurecimento e o consequente aumento da espessura da parede do cólon podem tornar o uso de modalidades térmicas mais seguras, de modo que aplicações repetidas da sonda bipolar ou pinça coagulante podem ser usadas para a hemostasia com menos risco de perfuração.
Tratamento do sangramento pós-polipectomia que não responde às medidas endoscópicas
Outras opções incluem terapia angiográfica (por exemplo, embolização seletiva) e cirurgia para remover a porção do cólon que contém o local da polipectomia.
A terapia angiográfica é preferível à cirurgia para pacientes com hemorragia não controlada porque é eficaz, e menos invasiva. A embolização arterial transcateter superseletiva com micromolas tem sido eficaz no controle do sangramento refratário à terapia endoscópica em relatos de casos.
A cirurgia pode ser necessária em pacientes com sangramento persistente após a tentativa do tratamento endoscópico e outras intervenções falham ou não estejam disponíveis. Se apenas um pólipo foi removido, o local do sangramento é identificado pela tatuagem com nanquim realizada na colonoscopia de urgência nos casos em que não se consegue controlar o sangramento por métodos endoscópicos.
Uma colectomia subtotal pode ser necessária se vários pólipos forem removidos em várias áreas do cólon e um exame colonoscópico não puder identificar o local do sangramento da polipectomia.
Resultados do tratamento de pacientes com sangramento pós-polipectomia tardio
Felizmente, para os pacientes que apresentam sangramento pós-polipectomia, essa complicação geralmente não está associada a nenhuma sequela importante a longo prazo. Em um estudo de 1.657 indivíduos submetidos à polipectomia, houve 5 com sangramento pós-polipectomia tardio, todos os quais receberam transfusão de sangue. Todos foram tratados com sucesso por nova colonoscopia. Nenhum desses indivíduos necessitou de cirurgia e nenhum morreu.
Considerações ao encaminhar pacientes com doenças cardiovasculares para colonoscopia
Ao encaminhar pacientes para colonoscopia, é muito importante avaliar cuidadosamente o uso de agentes antiplaquetários ou anticoagulantes e o momento da colonoscopia. O uso de agentes antiplaquetários e anticoagulantes está aumentando devido às altas taxas de doença arterial coronariana e doença cerebrovascular. Ao considerar uma colonoscopia, os riscos de suspender esses medicamentos e, portanto, precipitar eventos trombóticos, devem ser cuidadosamente ponderados em relação aos riscos de continuar esses agentes durante procedimentos endoscópicos que pode ser complicado por sangramento, particularmente procedimentos com intervenções de alto risco de sangramento, como polipectomia.
Além disso, quando o tratamento com agentes que aumentam o risco de sangramento é de curta duração, os procedimentos eletivos devem ser adiados até que a terapia seja concluída. Também deve-se ter em mente que, embora a polipectomia apresente risco de hemorragia, muitos dos pacientes que estão sendo submetidos à colonoscopia para rastreamento ou vigilância do câncer de cólon não precisarão de polipectomia durante a colonoscopia; no entanto, isso não é conhecido até que o procedimento seja concluído. Ao considerar a endoscopia para pacientes em uso de anticoagulantes, várias questões importantes devem ser ponderadas.
Questões a serem consideradas ao avaliar um paciente em uso de agentes anticoagulantes ou antiplaquetários para colonoscopia.
- Qual é a urgência do procedimento?
- A colonoscopia realmente precisa ser realizada imediatamente ou o paciente pode esperar com segurança alguns meses até que os anticoagulantes sejam retirados e/ou o risco de eventos trombóticos seja menor?
- Qual é o risco de sangramento (relacionado ao medicamento e ao procedimento planejado)?
- É provável que o procedimento seja apenas diagnóstico ou inclua uma intervenção com alto risco de sangramento?
- Qual é o risco de interrupção do medicamento (ou seja, evento tromboembólico)?
- O risco de um evento tromboembólico é maior do que o de uma complicação hemorrágica do procedimento endoscópico?
- Se o medicamento for retirado temporariamente, qual é o momento ideal de retirada e retorno do medicamento, e o medicamento precisa ser readministrado?
Gerenciamento da ASPIRINA durante a colonoscopia
A aspirina inativa irreversivelmente as plaquetas durante sua vida útil, de 7 a 10 dias. No entanto, com base em vários estudos retrospectivos, as diretrizes concordam que a aspirina pode ser continuada com segurança durante a colonoscopia com polipectomia sem preocupação com um aumento significativo do sangramento. Além disso, os riscos cardiovasculares associados à retirada da aspirina podem ser altos, especialmente em pacientes com história de doença arterial coronariana.
Gerenciamento das TIENOPIRIDINAS (clopidogrel) durante a colonoscopia
As tienopiridinas inibem a função plaquetária. Em pacientes com doença arterial coronariana, especialmente no contexto de stents coronários. As tienopiridinas são mais frequentemente administradas em combinação com aspirina, que é denominada terapia antiplaquetária dupla (DAPT).
Pacientes usando tienopiridinas durante a polipectomia apresentam uma taxa de sangramento pós-polipectomia significativamente maior (2,4%) quando comparados aos demais pacientes (0,3 a 1,2%). O risco é ainda maior quando as tienopiridina estão associadas à aspirina.
Embora o sangramento pós-polipectomia seja uma complicação que possa ser evitada com a suspenção das tienopiridinas, é importante notar que essa complicação tem baixa mortalidade associada, porque geralmente é tratada sem cirurgia e não tem consequências a longo prazo. Portanto, deve-se considerar sempre o risco de eventos tromboembólicos relacionados à retirada de agentes antiplaquetários, incluindo trombose de stent.
As diretrizes de 2016 da American Society for Gastrointestinal Endoscopy (ASGE) recomendam, em geral, a interrupção das tienopiridinas e a manutenção da aspirina para os procedimentos colonoscópicos planejados com alto risco de sangramento, como a polipectomia. No entanto, para pessoas com alto risco de tromboembolismo, deve-se considerar adiar o procedimento colonoscópico até que o risco de descontinuação das tienopiridinas seja menor (por exemplo, esperar até 12 meses após a colocação de um stent coronário farmacológico). Além disso, a urgência do procedimento deve ser ponderada. Por exemplo, adiar a colonoscopia de triagem ou vigilância por no mínimo 12 meses, mas reduzir para 6 meses para um paciente assintomático com anemia por deficiência ferro.
Também deve ser considerada a realização da colonoscopia sem suspender as tienopiridinas após uma cuidadosa ponderação de riscos e benefícios se houver alta urgência para o procedimento. Além disso, para procedimentos endoscópicos considerados de baixo risco de sangramento (por exemplo, colonoscopia diagnóstica para avaliar anemia ferropriva sem plano de polipectomia), a recomendação da ASGE é continuar os agentes durante o procedimento.
Se o adiamento da colonoscopia for considerado desaconselhável, o risco de tromboembolismo não for alto e o procedimento planejado for de alto risco de sangramento, a tienopiridina deve ser descontinuada 5 a 7 dias antes do procedimento. Mas se o risco de tromboembolismo for aumentado recomenda-se o uso de heparina de baixo peso molecular subcutânea como ponte durante os dias de suspensão das tienopiridinas, interrompendo 24 horas antes do exame.
Gerenciamento da Varfarina durante a colonoscopia
A varfarina é um agente anticoagulante comumente usado para o tratamento de uma variedade de distúrbios, incluindo trombose venosa profunda (TVP); embolia pulmonar; acidente vascular cerebral isquêmico; e profilaxia de tromboembolismo arterial de fibrilação atrial, flutter e distúrbios valvulares cardíacos.
É importante lembrar que, embora o objetivo de interromper os anticoagulantes periprocedimento seja reduzir o risco de sangramento, os pacientes que estão em terapia com varfarina ainda apresentam risco aumentado de sangramento pós-procedimento, apesar da retirada do medicamento antes do exame como recomendado.
Um estudo retrospectivo comparou o sangramento pós-polipectomia tardio em indivíduos que interromperam a varfarina com indivíduos que não estavam em uso de varfarina e encontrou taxas significativamente mais altas de sangramento naqueles que usaram varfarina apesar de ter sido retirada para os exames.
Semelhante às recomendações da ASGE para agentes antiplaquetários, a decisão de retirar ou continuar a varfarina durante a colonoscopia baseia-se na avaliação do risco de sangramento do procedimento planejado, o risco de tromboembolismo se a droga for suspensa e a urgência do procedimento. Se o procedimento for de baixo risco de sangramento (p. colonoscopia diagnóstica sem plano de polipectomia), a varfarina pode ser continuada durante o procedimento. Especificamente, a biópsia da mucosa é segura para ser realizada durante a colonoscopia para pacientes em uso de varfarina cuja razão normalizada internacional está na faixa terapêutica (RNI-alvo de 2,0 e 3,0).
No entanto, as diretrizes atuais recomendam que, para procedimentos de alto risco como a polipectomia, a varfarina deve ser interrompida 5 dias antes do exame. Quando é tomada a decisão de descontinuar a varfarina, o risco de tromboembolismo deve ser ponderado na decisão de fazer ou não ponte da varfarina com um anticoagulante de ação curta, como a heparina de baixo peso molecular. Para condições de alto risco de tromboembólico, deve-se considerar adiar o procedimento, principalmente se a duração do tratamento do anticoagulante pode ser alcançada em breve (por exemplo, 6 meses de varfarina para um TVP). Se o adiamento for considerado desaconselhável e o risco de tromboembolismo for alto, a varfarina deve ser descontinuada e iniciada a ponte com heparina de baixo peso molecular e retirada no dia anterior ao procedimento (ou seja, última dose 24 horas antes do procedimento).
Gerenciamento de anticoagulantes orais de ação direta durante a colonoscopia
Os anticoagulantes orais diretos (DOACs) são uma nova classe de anticoagulantes que inibem diretamente a trombina. Dabigatrana - (Pradaxa®) ou o fator Xa Rivaroxabana (Xarelto®), Apixabana (Eliquis®) e Edoxabana (Lixiana®) na cascata da coagulação.
As principais vantagens dos DOACs em relação à varfarina é que não necessitam de monitoramento com exames de sangue, menos interações com a dieta e outros medicamentos e início e eliminação mais rápidos da ação (com função renal normal).
Por outro lado, esses agentes são mais caros que a varfarina e, com a exceção da dabigatrana, não há meios disponíveis para reverter o efeito anticoagulante em caso de sangramento. Semelhante à varfarina, os DOACs aumentam o risco de sangramento de todas as causas. Não relacionado à polipectomia, a taxa de sangramento gastrointestinal (GI) foi maior para indivíduos tratados com dabigatrana (3% vs 2%), rivaroxabana (3,2% vs 2,2%) ou edoxabana (1,5% vs 1,2%) em comparação com indivíduos que tomam varfarina.
A razão para o risco aumento de sangramento GI com os DOACs não é claro. Nenhum estudo explorou especificamente taxas de sangramento com procedimentos endoscópicos de alto risco, como polipectomia; no entanto, um pequeno estudo japonês descobriu que a biópsia endoscópica da mucosa parece ser segura para pacientes em uso de dabigatrana.
As diretrizes mais recentes da ASGE (2016) incluíram recomendações sobre a gestão dos DOACs nos exames endoscópicos. Tal como acontece com outros agentes antiplaquetários e anticoagulantes, para procedimentos com baixo risco de sangramento, os DOACs provavelmente podem ser mantidos com segurança. Para procedimentos com alto risco de sangramento, como a polipectomia, os DOACs devem ser retirados antes do exame. Dado o rápido início e eliminação (com função renal normal) desses agentes, não há necessidade de ponte periprocedimento. As diretrizes recomendam manter esses agentes por 2 a 3 meias-vidas antes do procedimento (1 a 2 dias). Para pacientes com doença renal leve a moderada (clearance de creatinina <50 mL/min), o medicamento deve ser retirado 3 a 5 dias antes do procedimento. Geralmente, após o procedimento, o agente pode ser readministrado imediatamente ou dentro de vários dias, dependendo do risco de sangramento para a intervenção que foi realizada.
Quando readministrar as drogas anticoagulantes após o procedimento
Após tomar a decisão de descontinuar um antiplaquetário ou anticoagulante em preparação para um procedimento endoscópico, a próxima decisão importante é quando readministrar o medicamento após o procedimento. Infelizmente, as diretrizes não fornecem um consenso claro porque há muitos poucos estudos para basear as recomendações.
Para tienopiridinas, o ACC/ACG (diretrizes conjuntas do American College of Cardiology e American College of Gastroenterology) recomendam a readministração “assim que possível”, a ASGE recomenda o tempo com base na ponderação dos riscos de doença tromboembólica com a suspensão da medicação e os riscos de sangramento com base no procedimento realizado com readministração imediata, e a Sociedade Britânica de Gastroenterologia recomenda a readministração no dia seguinte ao procedimento. Todas essas recomendações são baseadas em opinião porque não há dados definitivos para orientar essas decisões.
Ao readministrar uma tienopiridina, outra questão controversa é se existe a necessidade de uma dose de ataque da droga (para obter níveis terapêuticos mais rápidos). Ao readministrar o clopidogrel em sua dose oral usual (75 mg ao dia), leva de 5 a 10 dias para atingir inibição plaquetária máxima, em comparação com 12 a 15 horas se o paciente receber 300 a 600 mg. A diretriz do JACC/ACG recomenda que a decisão quanto à necessidade da dose de ataque baseia-se no risco de doença tromboembólicos.
Para pacientes que estavam em uso de varfarina sem ponte, as diretrizes da ASGE recomendam a readministração da varfarina em 24 horas. Para os pacientes que estavam em varfarina que foi ponteada, a varfarina deve ser readministrada na noite do procedimento, enquanto a heparina deve ser retomada o mais rápido possível após o procedimento e retirada assim que o RNI se tornar terapêutico. No entanto, o ajuste dessas diretrizes deve ser caso a caso no cenário de procedimentos de alto risco de sangramento, como grandes polipectomias, porque mesmo a reintrodução da varfarina após 7 dias da polipectomia é fator de risco para sangramento pós-polipectomia tardio.
Para pacientes em uso de DOACs, a ASGE recomenda que esses agentes também sejam readministrados o mais rápido possível. Nos casos em que não podem ser readministrados dentro de 24 horas devido à preocupação com alto risco de sangramento, deve-se considerar a ponte com heparina para aqueles com alto risco tromboembólico.
Inegavelmente, a perfuração, embora rara, é a complicação mais preocupante e grave da colonoscopia diagnóstica ou terapêutica.
As perfurações geralmente ocorrem devido a um dos três mecanismos: (1) trauma mecânico causado pela pressão exercida pelo colonoscópio na parede do cólon (geralmente no segmento retossigmóide ou no reto durante a manobra de retroflexão do endoscópio em um reto pequeno) ou no local de uma estenose; (2) barotrauma por distensão excessiva do intestino (tipicamente o ceco); ou (3) de resultado direto de procedimentos terapêuticos como a mucosectomia.
Como esperado, a incidência de perfuração após colonoscopia terapêutica é nitidamente maior do que após colonoscopia diagnóstica, e o risco varia de acordo com o procedimento (Tabela 1). Após a polipectomia padrão com alça, uma perfuração se desenvolve com mais frequência quando os pólipos são >1 cm no cólon direito ou >2 cm no cólon esquerdo. A taxa de mortalidade associada à perfuração iatrogênica varia de 0 a 0,65%. Tem sido sugerido que uma incidência de perfuração superior a 1 em 500 colonoscopias ou superior a 1 em 1000 em colonoscopias de triagem deve levar a uma auditoria para revisão dos procedimentos.
As perfurações geralmente ocorrem devido a um dos três mecanismos: (1) trauma mecânico causado pela pressão exercida pelo colonoscópio na parede do cólon (geralmente no segmento retossigmóide ou no reto durante a manobra de retroflexão do endoscópio em um reto pequeno) ou no local de uma estenose; (2) barotrauma por distensão excessiva do intestino (tipicamente o ceco); ou (3) de resultado direto de procedimentos terapêuticos como a mucosectomia.
Como esperado, a incidência de perfuração após colonoscopia terapêutica é nitidamente maior do que após colonoscopia diagnóstica, e o risco varia de acordo com o procedimento (Tabela 1). Após a polipectomia padrão com alça, uma perfuração se desenvolve com mais frequência quando os pólipos são >1 cm no cólon direito ou >2 cm no cólon esquerdo. A taxa de mortalidade associada à perfuração iatrogênica varia de 0 a 0,65%. Tem sido sugerido que uma incidência de perfuração superior a 1 em 500 colonoscopias ou superior a 1 em 1000 em colonoscopias de triagem deve levar a uma auditoria para revisão dos procedimentos.
Devido ao mecanismo de lesão, trauma mecânico, as perfurações de uma colonoscopia diagnóstica são tipicamente grandes (> 2 cm) e localizadas no sigmoide. A lesão geralmente é produzida por trauma direto devido a uma introdução imprecisa do colonoscópio, movimentos do colonoscópio em direção à superfície da mucosa, manobras de retroflexão ou torção excessiva. Lesões indiretas também podem ocorrer como consequência do encurvamento ou alongamento da parte distal do cólon. A presença de divertículos em um cólon redundante ou aderências de cirurgias anteriores aumentam o risco de trauma mecânico durante a colonoscopia.
O barotrauma é produzido pela distensão excessiva do intestino devido à super insuflação, que produz lacerações lineares na parede do cólon que podem evoluir para defeitos de espessura total. Esse tipo de perfuração localiza-se mais frequentemente na região cecal, onde a camada muscular mais fina e o maior diâmetro do lúmen tornam essa região mais vulnerável a lesões por pressão.
Nas colonoscopias terapêuticas o mecanismo de perfuração pode ser o mesmo que ocorre durante a colonoscopia diagnóstica, ou pode ser devido à lesão térmica/elétrica da parede do cólon vista no momento ou manifestando-se como uma isquemia da parede, quando geralmente são menores. Neste último caso, a perfuração pode ocorrer com atraso de 24 a 72 h. O dano da parede pode ser incompleto e a perfuração oculta, pois é confinada pelos tecidos circundantes. Durante os dias ou semanas seguintes, pode desenvolver-se um abcesso que pode atrasar o diagnóstico.
A presença de aderências, doença diverticular grave, inflamação da mucosa, estenose, comorbidades, idade avançada, uso incorreto de corrente de corte ou coagulação, ressecção de pólipos com mais de 1 cm de tamanho localizados no cólon direito e experiência limitada do operador estão associados a um maior risco de perfuração em colonoscopias diagnósticas. A sedação profunda pode aumentar o risco de perfuração em comparação com sedação consciente, uma vez que se perde a resposta do paciente à dor, quando profundamente sedado.
Notavelmente, o emprego de técnicas avançadas de ressecção de mucosa (mucosectomia e dissecção de submucosa) aumentaram o risco de perfuração; no entanto, em nível populacional, o número desses procedimentos avançados como porcentagem de todas as polipectomias é pequeno.
Certas populações enfrentam maiores riscos de perfuração durante a colonoscopia, incluindo pacientes com diverticulose e doença inflamatória intestinal (DII). Pacientes com DII submetidos à colonoscopia pode ter um risco até 8 vezes maior de perfurações em comparação com pacientes sem DII. O uso de corticosteroides está associado a um risco 13 vezes maior de perfuração associada à colonoscopia.
Fatores de risco adicionais para perfuração incluem:
(1) A mobilidade reduzida do cólon que pode ser devido a aderências, divertículos, radioterapia, malignidade ou infecção.
(2) Anormalidades na mucosa podem ocorrer como resultado de doença inflamatória intestinal, malignidade, infecção, radioterapia, necrose ou ruptura parcial. Essas anormalidades podem causar fraqueza na parede do cólon e predispor à perfuração.
(3) Endoscopistas com baixo volume de exames apresentam taxas maiores de perfuração.
O barotrauma é produzido pela distensão excessiva do intestino devido à super insuflação, que produz lacerações lineares na parede do cólon que podem evoluir para defeitos de espessura total. Esse tipo de perfuração localiza-se mais frequentemente na região cecal, onde a camada muscular mais fina e o maior diâmetro do lúmen tornam essa região mais vulnerável a lesões por pressão.
Nas colonoscopias terapêuticas o mecanismo de perfuração pode ser o mesmo que ocorre durante a colonoscopia diagnóstica, ou pode ser devido à lesão térmica/elétrica da parede do cólon vista no momento ou manifestando-se como uma isquemia da parede, quando geralmente são menores. Neste último caso, a perfuração pode ocorrer com atraso de 24 a 72 h. O dano da parede pode ser incompleto e a perfuração oculta, pois é confinada pelos tecidos circundantes. Durante os dias ou semanas seguintes, pode desenvolver-se um abcesso que pode atrasar o diagnóstico.
A presença de aderências, doença diverticular grave, inflamação da mucosa, estenose, comorbidades, idade avançada, uso incorreto de corrente de corte ou coagulação, ressecção de pólipos com mais de 1 cm de tamanho localizados no cólon direito e experiência limitada do operador estão associados a um maior risco de perfuração em colonoscopias diagnósticas. A sedação profunda pode aumentar o risco de perfuração em comparação com sedação consciente, uma vez que se perde a resposta do paciente à dor, quando profundamente sedado.
Notavelmente, o emprego de técnicas avançadas de ressecção de mucosa (mucosectomia e dissecção de submucosa) aumentaram o risco de perfuração; no entanto, em nível populacional, o número desses procedimentos avançados como porcentagem de todas as polipectomias é pequeno.
Certas populações enfrentam maiores riscos de perfuração durante a colonoscopia, incluindo pacientes com diverticulose e doença inflamatória intestinal (DII). Pacientes com DII submetidos à colonoscopia pode ter um risco até 8 vezes maior de perfurações em comparação com pacientes sem DII. O uso de corticosteroides está associado a um risco 13 vezes maior de perfuração associada à colonoscopia.
Fatores de risco adicionais para perfuração incluem:
(1) A mobilidade reduzida do cólon que pode ser devido a aderências, divertículos, radioterapia, malignidade ou infecção.
(2) Anormalidades na mucosa podem ocorrer como resultado de doença inflamatória intestinal, malignidade, infecção, radioterapia, necrose ou ruptura parcial. Essas anormalidades podem causar fraqueza na parede do cólon e predispor à perfuração.
(3) Endoscopistas com baixo volume de exames apresentam taxas maiores de perfuração.
Principais etiologias da perfuração colonoscopia iatrogênica
Tipo de lesão
• Trauma mecânico direto
• Barotrauma
• Lesão térmica/elétrica
Procedimentos terapêuticos endoscópicos com risco de perfuração colonoscopia iatrogênica
• Stent colorretal
• Polipectomia
• Dilatação do cólon
• Coagulação por plasma de argônio (APC)
• Ressecção endoscópica da mucosa (EMR)
• Dissecção endoscópica da submucosa (ESD)
Tipo de lesão
• Trauma mecânico direto
• Barotrauma
• Lesão térmica/elétrica
Procedimentos terapêuticos endoscópicos com risco de perfuração colonoscopia iatrogênica
• Stent colorretal
• Polipectomia
• Dilatação do cólon
• Coagulação por plasma de argônio (APC)
• Ressecção endoscópica da mucosa (EMR)
• Dissecção endoscópica da submucosa (ESD)
Prevenção da perfuração cólica durante a colonoscopia
Na colonoscopia diagnóstica ou de prevenção, a progressão do colonoscópio deve ser realizada de forma suave e cautelosa, e a formação de alça deve ser evitada ou minimizada. Quando ocorrer dor abdominal durante o exame, manobras alternativas (manobra auxiliar, compressão do abdome e mudança de decúbito) devem ser utilizadas e, quando se observa dificuldade objetiva de progressão, desistir é melhor do que infligir dano (grau de recomendação 1C).
Dificuldade incomum em atravessar o cólon sigmóide, exame difícil em paciente do sexo feminino ou idoso, ou a presença de doença diverticular ou obstrução colônica devem ser considerados condições alarmantes (grau de recomendação 1C).
O uso criterioso da insuflação de ar pode reduzir o risco de perfuração devido a um barotrauma, especialmente na presença de estenose visceral e em procedimentos mais demorados (grau de recomendação 1B).
Na retirada de pólipos (polipectomia), a alça de coagulação deve ser posicionada com precisão, promovendo o levantamento da mucosa do músculo subjacente da parede intestinal. Também é importante limitar a quantidade de tecido incluída na alça a um máximo de 2 cm, quando o pólipo for maior, recomenda-se fazer a técnica de fatiamento ou fragmentada (piecemeal) (grau de recomendação 1C).
Para a retirada de pólipos planos ou pouco elevados de qualquer tamanho, recomenda-se a retirada a frio (sem eletrocautério) em um fragmento ou em 2 ou mais fragmentos com ou sem a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa quando risco de perfurações se aproxima de zero (grau de recomendação 1C).
Para a retirada de pólipos sésseis maiores do que 10 mm, recomenda-se a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa reduzindo o risco de dano da eletrocoagulação na parede muscular (grau de recomendação 1C).
Atenção especial deve ser dada durante a remoção de pólipos no ceco, onde a parede fina pode predispor à perfuração, portanto, deve ser evitada o uso do eletrocautério (grau de recomendação 1C).
O uso do modo de corrente mista pode levar a danos nos tecidos muito menos profundos do que o modo de coagulação pura. Alguns estudos relataram um risco aumentado de perfuração durante a remoção de pequenos pólipos com uma pinça de biópsia quente (eletrocautério), enquanto um baixo risco está associado à polipectomia com alça fria (grau de recomendação 1C).
A dissecção endoscópica da submucosa (ESD) deve ser limitada a casos selecionados devido à alta taxa de complicações associadas (grau de recomendação 1C).
No que diz respeito ao tratamento com stent de estenose maligna, uma maior taxa de perfuração foi relatada em pacientes que receberam quimioterapia com bevacizumab. Portanto, a colocação de stent nesses pacientes deve ser desencorajada. Além disso, a dilatação de uma área estenótica antes ou após a colocação do stent não é aconselhável. Da mesma forma, a dilatação de massas tumorais ou segmentos inflamados ativamente em pacientes com doença de Crohn deve ser evitada.
Finalmente, a experiência limitada do médico colonoscopista, ou seja, durante a curva de aprendizado, está associada a um risco aumentado de perfuração durante os exames diagnósticos e terapêuticos.
Se a perfuração cólica for detectada durante o procedimento pelo endoscopista, uma descrição detalhada deve ser fornecida incluindo as seguintes informações:
Na colonoscopia diagnóstica ou de prevenção, a progressão do colonoscópio deve ser realizada de forma suave e cautelosa, e a formação de alça deve ser evitada ou minimizada. Quando ocorrer dor abdominal durante o exame, manobras alternativas (manobra auxiliar, compressão do abdome e mudança de decúbito) devem ser utilizadas e, quando se observa dificuldade objetiva de progressão, desistir é melhor do que infligir dano (grau de recomendação 1C).
Dificuldade incomum em atravessar o cólon sigmóide, exame difícil em paciente do sexo feminino ou idoso, ou a presença de doença diverticular ou obstrução colônica devem ser considerados condições alarmantes (grau de recomendação 1C).
O uso criterioso da insuflação de ar pode reduzir o risco de perfuração devido a um barotrauma, especialmente na presença de estenose visceral e em procedimentos mais demorados (grau de recomendação 1B).
Na retirada de pólipos (polipectomia), a alça de coagulação deve ser posicionada com precisão, promovendo o levantamento da mucosa do músculo subjacente da parede intestinal. Também é importante limitar a quantidade de tecido incluída na alça a um máximo de 2 cm, quando o pólipo for maior, recomenda-se fazer a técnica de fatiamento ou fragmentada (piecemeal) (grau de recomendação 1C).
Para a retirada de pólipos planos ou pouco elevados de qualquer tamanho, recomenda-se a retirada a frio (sem eletrocautério) em um fragmento ou em 2 ou mais fragmentos com ou sem a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa quando risco de perfurações se aproxima de zero (grau de recomendação 1C).
Para a retirada de pólipos sésseis maiores do que 10 mm, recomenda-se a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa reduzindo o risco de dano da eletrocoagulação na parede muscular (grau de recomendação 1C).
Atenção especial deve ser dada durante a remoção de pólipos no ceco, onde a parede fina pode predispor à perfuração, portanto, deve ser evitada o uso do eletrocautério (grau de recomendação 1C).
O uso do modo de corrente mista pode levar a danos nos tecidos muito menos profundos do que o modo de coagulação pura. Alguns estudos relataram um risco aumentado de perfuração durante a remoção de pequenos pólipos com uma pinça de biópsia quente (eletrocautério), enquanto um baixo risco está associado à polipectomia com alça fria (grau de recomendação 1C).
A dissecção endoscópica da submucosa (ESD) deve ser limitada a casos selecionados devido à alta taxa de complicações associadas (grau de recomendação 1C).
No que diz respeito ao tratamento com stent de estenose maligna, uma maior taxa de perfuração foi relatada em pacientes que receberam quimioterapia com bevacizumab. Portanto, a colocação de stent nesses pacientes deve ser desencorajada. Além disso, a dilatação de uma área estenótica antes ou após a colocação do stent não é aconselhável. Da mesma forma, a dilatação de massas tumorais ou segmentos inflamados ativamente em pacientes com doença de Crohn deve ser evitada.
Finalmente, a experiência limitada do médico colonoscopista, ou seja, durante a curva de aprendizado, está associada a um risco aumentado de perfuração durante os exames diagnósticos e terapêuticos.
Se a perfuração cólica for detectada durante o procedimento pelo endoscopista, uma descrição detalhada deve ser fornecida incluindo as seguintes informações:
- Indicação de colonoscopia (ou seja, diagnóstica ou terapêutica).
- Patologia colônica associada (por exemplo, estenoses, pólipos, tumores).
- Administração de sedação, analgesia ou anestesia para a colonoscopia.
- Estado geral do paciente e presença de comorbidades.
- Tipo de gás usado para insuflação.
- Qualidade da preparação do cólon.
- Hora da ocorrência da perfuração.
- Causa mais provável para a perfuração (por exemplo, lesão térmica, lesão mecânica).
- Localização e tamanho da lesão.
- Se um tratamento endoscópico foi tentado ou concluído.
- Como foi realizado o reparo endoscópico.
- Presença de distensão abdominal aumentando a probabilidade de síndrome compartimental abdominal.
Diagnóstico da perfuração cólica durante a colonoscopia
O local mais comum de perfuração é o cólon sigmóide (53-65 %), seguido pelo ceco, cólon ascendente, cólon transverso, cólon descendente e reto.
O local mais comum de perfuração é o cólon sigmóide (53-65 %), seguido pelo ceco, cólon ascendente, cólon transverso, cólon descendente e reto.
Aproximadamente 45-60% das perfurações são detectadas pelo endoscopista durante a realização da colonoscopia, embora um número considerável não seja reconhecido imediatamente, mas sim suspeitada com base nos sinais e sintomas clínicos ocorridos após o procedimento endoscópico.
Geralmente, a perfuração ocorre durante o exame ou nas primeiras 24 horas após o procedimento devido a progressão da lesão térmica ou isquêmica. O diagnóstico precoce é fundamental para o tratamento e prognóstico. Durante a colonoscopia, o diagnóstico geralmente é realizado pela visão direta do defeito da parede ou pela visualização dos tecidos intra-abdominais através da parede do cólon ou, após a ressecção, pelo chamado sinal do alvo, ou seja, evidência de secção da camada muscular sobre a lesão ressecada.
Um atraso no diagnóstico da perfuração é uma questão crítica para os resultados do tratamento; quando o diagnóstico demora mais de 24 h, aumenta a chance de que tratamentos mais invasivos (por exemplo, cirurgia) sejam necessários. Para uma perfuração intestinal não vista durante a colonoscopia, o diagnóstico é baseado em achados clínicos, laboratoriais e radiológicos.
A apresentação clínica de uma perfuração pode variar amplamente, dependendo do tamanho da perfuração, do tipo de agente etiológico, da localização no cólon, do grau de contaminação intraperitoneal e do estado geral do paciente. Na maioria dos pacientes (91-92%), os sintomas se desenvolvem nas primeiras 48 horas após a conclusão da colonoscopia. O sintoma mais comum é a dor abdominal associada à distensão, embora tenham sido descritos casos indolores ou casos com dor tipo cãibra intensa.
Outros sintomas encontrados com frequência incluem a sensibilidade abdominal descompressiva em defesa/rebote (82,5) com peritonite difusa, taquicardia (62,5%), leucocitose (40%), febre (38%), sangramento retal (15%) e distensão abdominal isolada (6,6%). Apenas um pequeno número de pacientes com perfuração (5%) permaneceu assintomático.
Cenários clínicos semelhantes a peritonite também podem ocorrer na ausência de perfuração. Por exemplo, uma lesão térmica transmural após polipectomia com irritação serosa sem qualquer perfuração óbvia produz peritonite localizada que é passível de tratamento não cirúrgico. Assim, exames bioquímicos e de imagem estão sempre indicados quando há suspeita de perfuração na colonoscopia.
Exames laboratoriais devem ser realizados para marcadores inflamatórios que podem revelar infecções bacterianas graves associadas à perfuração, como contagem de glóbulos brancos (WBC) e proteína C reativa (PCR). Em caso de apresentação tardia (> 12 h), o nível de pró-calcitonina (PCT) pode ser útil para o diagnóstico.
A perfuração intraperitoneal leva ao extravasamento de ar e conteúdo cólico para a cavidade abdominal. Em caso de suspeita, radiografias simples de tórax e abdome podem demonstrar ar livre, embora a TC (tomografia computadorizada) seja superior a uma radiografia de tórax em posição vertical (posição de pé). Se a suspeita clínica persistir após uma radiografia simples normal, uma tomografia computadorizada (TC) de abdome com realce de contraste deve ser solicitada, pois essa ferramenta de imagem pode detectar facilmente pequenas quantidades de ar e líquidos intraperitoneais livres, em alguns casos com os focos do gás reunidos perto do local da perfuração.
Deve-se suspeitar de perfuração tardia quando ocorrer dor abdominal, distensão abdominal, sinais de peritonite localizada ou difusa, febre e/ou leucocitose após o procedimento. O aparecimento de peritonite generalizada, sepse e instabilidade hemodinâmica representam fatores prognósticos negativos, exigindo cirurgia de urgência. O tratamento cirúrgico convencional de complicações perfurantes está associado a uma morbidade relativamente alta (entre 5 e 30%) e mortalidade.
Raramente, a perfuração cólica é extraperitoneal, levando à passagem de ar para o espaço retroperitoneal, que pode então se difundir ao longo dos planos fasciais e grandes vasos, causando pneumoretroperitônio, pneumomediastino, pneumopericárdio, pneumotórax e enfisema subcutâneo. Esses pacientes podem ter uma apresentação atípica, incluindo crepitação subcutânea, edema no pescoço, dor torácica e falta de ar após a colonoscopia.
As recomendações a seguir foram desenvolvidas usando uma grande série clínica e opiniões de especialistas, uma vez que faltam estudos randomizados sobre esse tema.
Geralmente, a perfuração ocorre durante o exame ou nas primeiras 24 horas após o procedimento devido a progressão da lesão térmica ou isquêmica. O diagnóstico precoce é fundamental para o tratamento e prognóstico. Durante a colonoscopia, o diagnóstico geralmente é realizado pela visão direta do defeito da parede ou pela visualização dos tecidos intra-abdominais através da parede do cólon ou, após a ressecção, pelo chamado sinal do alvo, ou seja, evidência de secção da camada muscular sobre a lesão ressecada.
Um atraso no diagnóstico da perfuração é uma questão crítica para os resultados do tratamento; quando o diagnóstico demora mais de 24 h, aumenta a chance de que tratamentos mais invasivos (por exemplo, cirurgia) sejam necessários. Para uma perfuração intestinal não vista durante a colonoscopia, o diagnóstico é baseado em achados clínicos, laboratoriais e radiológicos.
A apresentação clínica de uma perfuração pode variar amplamente, dependendo do tamanho da perfuração, do tipo de agente etiológico, da localização no cólon, do grau de contaminação intraperitoneal e do estado geral do paciente. Na maioria dos pacientes (91-92%), os sintomas se desenvolvem nas primeiras 48 horas após a conclusão da colonoscopia. O sintoma mais comum é a dor abdominal associada à distensão, embora tenham sido descritos casos indolores ou casos com dor tipo cãibra intensa.
Outros sintomas encontrados com frequência incluem a sensibilidade abdominal descompressiva em defesa/rebote (82,5) com peritonite difusa, taquicardia (62,5%), leucocitose (40%), febre (38%), sangramento retal (15%) e distensão abdominal isolada (6,6%). Apenas um pequeno número de pacientes com perfuração (5%) permaneceu assintomático.
Cenários clínicos semelhantes a peritonite também podem ocorrer na ausência de perfuração. Por exemplo, uma lesão térmica transmural após polipectomia com irritação serosa sem qualquer perfuração óbvia produz peritonite localizada que é passível de tratamento não cirúrgico. Assim, exames bioquímicos e de imagem estão sempre indicados quando há suspeita de perfuração na colonoscopia.
Exames laboratoriais devem ser realizados para marcadores inflamatórios que podem revelar infecções bacterianas graves associadas à perfuração, como contagem de glóbulos brancos (WBC) e proteína C reativa (PCR). Em caso de apresentação tardia (> 12 h), o nível de pró-calcitonina (PCT) pode ser útil para o diagnóstico.
A perfuração intraperitoneal leva ao extravasamento de ar e conteúdo cólico para a cavidade abdominal. Em caso de suspeita, radiografias simples de tórax e abdome podem demonstrar ar livre, embora a TC (tomografia computadorizada) seja superior a uma radiografia de tórax em posição vertical (posição de pé). Se a suspeita clínica persistir após uma radiografia simples normal, uma tomografia computadorizada (TC) de abdome com realce de contraste deve ser solicitada, pois essa ferramenta de imagem pode detectar facilmente pequenas quantidades de ar e líquidos intraperitoneais livres, em alguns casos com os focos do gás reunidos perto do local da perfuração.
Deve-se suspeitar de perfuração tardia quando ocorrer dor abdominal, distensão abdominal, sinais de peritonite localizada ou difusa, febre e/ou leucocitose após o procedimento. O aparecimento de peritonite generalizada, sepse e instabilidade hemodinâmica representam fatores prognósticos negativos, exigindo cirurgia de urgência. O tratamento cirúrgico convencional de complicações perfurantes está associado a uma morbidade relativamente alta (entre 5 e 30%) e mortalidade.
Raramente, a perfuração cólica é extraperitoneal, levando à passagem de ar para o espaço retroperitoneal, que pode então se difundir ao longo dos planos fasciais e grandes vasos, causando pneumoretroperitônio, pneumomediastino, pneumopericárdio, pneumotórax e enfisema subcutâneo. Esses pacientes podem ter uma apresentação atípica, incluindo crepitação subcutânea, edema no pescoço, dor torácica e falta de ar após a colonoscopia.
As recomendações a seguir foram desenvolvidas usando uma grande série clínica e opiniões de especialistas, uma vez que faltam estudos randomizados sobre esse tema.
- Após colonoscopias diagnósticas ou terapêuticas, todos os pacientes que apresentarem dor e/ou sensibilidade abdominal e/ou distensão abdominal e/ou febre e/ou sangramento retal devem ser investigados para perfuração por exames laboratoriais e de imagem (Recomendação Grau 1B).
- Os marcadores bioquímicos mínimos que devem ser solicitados em caso de suspeita de perfuração são hemograma/leucograma e proteína C reativa (grau de recomendação 1C).
- A perfuração deve ser confirmada com a demonstração de ar livre intra ou extraperitoneal (Recomendação 1B). A tomografia computadorizada é mais sensível do que as radiografias abdominais padrão para detectar ar livre (grau de recomendação 1C).
- No caso de sinais peritoneais localizados, a tomografia computadorizada com contraste venoso e retal pode ser uma ferramenta auxiliar útil para confirmar a viabilidade do manejo não cirúrgico da perfuração (grau de recomendação 1C).
Representação das relações peritoneal e mesentérica em vários níveis do cólon e do reto
O cólon transverso e sigmóide estão localizados intraperitonealmente; nesses níveis, o peritônio visceral forma uma cobertura completa sobre o exterior do intestino (a serosa), que é contínuo com o mesentério (mesocólon transverso e sigmóide). Em contraste, o cólon ascendente e descendente se encontra dentro da cavidade peritoneal lateral, com sua superfície posterior e lateral estrão no retroperitônio. Nesses níveis, o peritônio visceral está presente apenas anteriormente e medialmente; não há verdadeiro mesentério, já que o mesentério em desenvolvimento se fundiu ao peritônio parietal posterior. A porção superior do reto está acima da reflexão peritoneal e a superfície anterior é coberta por peritônio que forma a bolsa retovesical em homens e a bolsa retouterina em mulheres, mas não existe serosa na sua superfície posterior.
Tratamento da perfuração colônica durante a colonoscopia
Uma vez que o diagnóstico de perfuração seja confirmado durante o exame ou tardiamente por exames clínicos e radiológicos, a decisão entre os tratamentos cirúrgico e não cirúrgico dependerá do tipo de lesão, da qualidade do preparo intestinal, da patologia colônica subjacente e da estabilidade clínica do paciente. No entanto, uma consulta com a cirurgia deve ser obtida em todos os casos de perfuração.
Sempre que houver suspeita de grande perfuração com o paciente apresentando sinais e sintomas de peritonite, a abordagem cirúrgica de emergência é razoável, recomendada e segura. O manejo cirúrgico também é recomendado em pacientes com doenças colônicas concomitantes que requerem cirurgia, pacientes transplantados e pacientes imunossuprimidos. Em pacientes selecionados com dor localizada, ar livre sem líquido livre difuso os exames de imagem, estabilidade hemodinâmica e ausência de febre, o manejo não cirúrgico (conservador) pode ser apropriado e está associada a baixa morbidade, baixa mortalidade e curta permanência hospitalar. O manejo conservador geralmente é adequado para pequenas perfurações bloqueadas que ocorreram durante uma colonoscopia terapêutica (polipectomia) em pacientes com uma preparação intestinal ideal.
O tratamento conservador consiste em monitoramento clínico e de imagem a cada 3-6 h, repouso intestinal absoluto (jejum), líquidos intravenosos para hidratação, administração intravenosa de antibióticos de amplo espectro e acompanhamento de equipe multidisciplinar para detectar prontamente o desenvolvimento de sepse e sinais de peritonite. A drenagem do ar peritoneal através de uma punção com agulha de Veress pode ser útil para aliviar a dor abdominal, melhorar a função respiratória e facilitar o fechamento do local da perfuração. A taxa geral de sucesso dos tratamentos conservadores para perfuração colônica varia de 33 a 90%.
Um sucesso inicial e precoce com o tratamento não cirúrgico não exclui a necessidade posterior de cirurgia. Se o tratamento conservador for bem-sucedido, a melhora clínica ocorrerá gradativamente em 24 horas, mas recomenda-se um acompanhamento clínico e bioquímico contínuo e rigoroso. Em casos de deterioração clínica ou progressão para quadro séptico ou peritonite, o tratamento cirúrgico não deve ser adiado. Apenas a presença de ar livre abaixo do diafragma não constitui indicação absoluta de cirurgia de urgência.
É importante notar que as taxas de complicações e o tempo de internação hospitalar são significativamente maiores em pacientes que foram submetidos à cirurgia após tratamento conservador do que em pacientes que foram inicialmente tratados com cirurgia. De fato, quando o tratamento cirúrgico é retardado, a peritonite e a inflamação da parede do cólon podem piorar, exigindo uma cirurgia mais invasiva que está associada a um pior prognóstico. Idealmente, a decisão de prosseguir com a cirurgia deve ser tomada o mais cedo possível após a colonoscopia.
O tratamento endoscópico é possível quando o local da perfuração é reconhecido durante o exame ou dentro de 4 horas após o procedimento e o preparo intestinal ainda é adequado. A terapia endoscópica urgente com colocação de endoclipe é valiosa, com altas taxas de sucesso e pode evitar a necessidade de cirurgia. A decisão de realizar o fechamento endoscópico da perfuração colônica depende do tamanho e da causa da lesão colônica, bem como da experiência do endoscopista e da disponibilidade de dispositivos endoscópicos apropriado.
O fechamento da perfuração com clipe endoscópico é recomendado para pequenas perfurações (menos de 1 cm) originadas de colonoscopias diagnósticas ou terapêuticas, com uma taxa de sucesso de 59-100%. Há poucos relatos na literatura sobre fechamento com clipes convencionais para perfurações maiores que 1 cm. Uma limitação do fechamento endoscópico é a dificuldade de avaliar a completude do fechamento colônico após a aplicação do clipe. Isso pode resultar em complicações tardias, como abscessos intra-abdominais devido a um vazamento intermitente.
Sempre que houver suspeita de grande perfuração com o paciente apresentando sinais e sintomas de peritonite, a abordagem cirúrgica de emergência é razoável, recomendada e segura. O manejo cirúrgico também é recomendado em pacientes com doenças colônicas concomitantes que requerem cirurgia, pacientes transplantados e pacientes imunossuprimidos. Em pacientes selecionados com dor localizada, ar livre sem líquido livre difuso os exames de imagem, estabilidade hemodinâmica e ausência de febre, o manejo não cirúrgico (conservador) pode ser apropriado e está associada a baixa morbidade, baixa mortalidade e curta permanência hospitalar. O manejo conservador geralmente é adequado para pequenas perfurações bloqueadas que ocorreram durante uma colonoscopia terapêutica (polipectomia) em pacientes com uma preparação intestinal ideal.
O tratamento conservador consiste em monitoramento clínico e de imagem a cada 3-6 h, repouso intestinal absoluto (jejum), líquidos intravenosos para hidratação, administração intravenosa de antibióticos de amplo espectro e acompanhamento de equipe multidisciplinar para detectar prontamente o desenvolvimento de sepse e sinais de peritonite. A drenagem do ar peritoneal através de uma punção com agulha de Veress pode ser útil para aliviar a dor abdominal, melhorar a função respiratória e facilitar o fechamento do local da perfuração. A taxa geral de sucesso dos tratamentos conservadores para perfuração colônica varia de 33 a 90%.
Um sucesso inicial e precoce com o tratamento não cirúrgico não exclui a necessidade posterior de cirurgia. Se o tratamento conservador for bem-sucedido, a melhora clínica ocorrerá gradativamente em 24 horas, mas recomenda-se um acompanhamento clínico e bioquímico contínuo e rigoroso. Em casos de deterioração clínica ou progressão para quadro séptico ou peritonite, o tratamento cirúrgico não deve ser adiado. Apenas a presença de ar livre abaixo do diafragma não constitui indicação absoluta de cirurgia de urgência.
É importante notar que as taxas de complicações e o tempo de internação hospitalar são significativamente maiores em pacientes que foram submetidos à cirurgia após tratamento conservador do que em pacientes que foram inicialmente tratados com cirurgia. De fato, quando o tratamento cirúrgico é retardado, a peritonite e a inflamação da parede do cólon podem piorar, exigindo uma cirurgia mais invasiva que está associada a um pior prognóstico. Idealmente, a decisão de prosseguir com a cirurgia deve ser tomada o mais cedo possível após a colonoscopia.
O tratamento endoscópico é possível quando o local da perfuração é reconhecido durante o exame ou dentro de 4 horas após o procedimento e o preparo intestinal ainda é adequado. A terapia endoscópica urgente com colocação de endoclipe é valiosa, com altas taxas de sucesso e pode evitar a necessidade de cirurgia. A decisão de realizar o fechamento endoscópico da perfuração colônica depende do tamanho e da causa da lesão colônica, bem como da experiência do endoscopista e da disponibilidade de dispositivos endoscópicos apropriado.
O fechamento da perfuração com clipe endoscópico é recomendado para pequenas perfurações (menos de 1 cm) originadas de colonoscopias diagnósticas ou terapêuticas, com uma taxa de sucesso de 59-100%. Há poucos relatos na literatura sobre fechamento com clipes convencionais para perfurações maiores que 1 cm. Uma limitação do fechamento endoscópico é a dificuldade de avaliar a completude do fechamento colônico após a aplicação do clipe. Isso pode resultar em complicações tardias, como abscessos intra-abdominais devido a um vazamento intermitente.
Quando o endoscopista não consegue fechar a perfuração com os endoclipes por motivos diversos ou não está seguro do seu fechamento completo, a cirurgia deve ser realizada o mais rapidamente possível.
Após um fechamento endoscópico bem-sucedido, é aconselhável que a cirurgia acompanhe o paciente juntamente com o endoscopista. O tratamento endoscópico é continuado com o jejum, antibioticoterapia de amplo espectro e hidratação intravenosa. A observação cuidadosa dos sinais de irritação peritoneal e o monitoramento dos parâmetros inflamatórios bioquímicos (PCR e leucograma) são cruciais. Quando a dor desaparece e os parâmetros inflamatórios e a função intestinal normalizam, a dieta oral pode ser retomada. A duração da observação é subjetiva, mas obviamente relacionada ao estado do paciente e à resposta ao tratamento conservador (não cirúrgico) ou endoscópico. A duração média da permanência hospitalar após o manejo não cirúrgico da perfuração varia de 9 a 13 dias.
Uma dieta líquida pode começar dentro de 1 a 2 dias após o início do manejo conservador da perfuração, de acordo com o estado clínico do paciente (Grau de Recomendação 1C).
Uma dieta líquida pode ser iniciada imediatamente após o reparo endoscópico da perfuração, de acordo com o estado clínico do paciente (Grau de recomendação 1C).
O paciente tratado para perfuração deve ser monitorado clinicamente, por exames laboratoriais e exames de imagem. Clinicamente, sinais peritoneais, como dor abdominal, sensibilidade rebote e proteção muscular, bem como sinais de infecção, como febre, náusea, vômito, distensão abdominal e diarreia, devem ser registrados. A avaliação frequente do estado físico e dos sinais vitais deve ser completada por exames laboratoriais para leucócitos, PCR, Hb, ureia e eletrólitos. A tomografia computadorizada continua sendo a ferramenta mais precisa a ser realizada em caso de deterioração clínica, principalmente quando a necessidade de cirurgia está em questão e pode ser realizada antes da alta hospitalar para confirmar a resolução com o tratamento não cirúrgico ou cirúrgico.
Após um fechamento endoscópico bem-sucedido, é aconselhável que a cirurgia acompanhe o paciente juntamente com o endoscopista. O tratamento endoscópico é continuado com o jejum, antibioticoterapia de amplo espectro e hidratação intravenosa. A observação cuidadosa dos sinais de irritação peritoneal e o monitoramento dos parâmetros inflamatórios bioquímicos (PCR e leucograma) são cruciais. Quando a dor desaparece e os parâmetros inflamatórios e a função intestinal normalizam, a dieta oral pode ser retomada. A duração da observação é subjetiva, mas obviamente relacionada ao estado do paciente e à resposta ao tratamento conservador (não cirúrgico) ou endoscópico. A duração média da permanência hospitalar após o manejo não cirúrgico da perfuração varia de 9 a 13 dias.
Uma dieta líquida pode começar dentro de 1 a 2 dias após o início do manejo conservador da perfuração, de acordo com o estado clínico do paciente (Grau de Recomendação 1C).
Uma dieta líquida pode ser iniciada imediatamente após o reparo endoscópico da perfuração, de acordo com o estado clínico do paciente (Grau de recomendação 1C).
O paciente tratado para perfuração deve ser monitorado clinicamente, por exames laboratoriais e exames de imagem. Clinicamente, sinais peritoneais, como dor abdominal, sensibilidade rebote e proteção muscular, bem como sinais de infecção, como febre, náusea, vômito, distensão abdominal e diarreia, devem ser registrados. A avaliação frequente do estado físico e dos sinais vitais deve ser completada por exames laboratoriais para leucócitos, PCR, Hb, ureia e eletrólitos. A tomografia computadorizada continua sendo a ferramenta mais precisa a ser realizada em caso de deterioração clínica, principalmente quando a necessidade de cirurgia está em questão e pode ser realizada antes da alta hospitalar para confirmar a resolução com o tratamento não cirúrgico ou cirúrgico.
Qual é o tipo e a duração recomendados da antibioticoterapia em pacientes submetidos a fechamento endoscópico bem-sucedido ou tratamento conservador da perfuração?
Em pacientes submetidos ao reparo endoscópico da perfuração, o controle da infecção geralmente é obtido com um curso de antibioticoterapia venosa de curto prazo (3 a 5 dias). Os antibióticos devem ser interrompidos se não houver sinais de inflamação sistêmica e/ou peritonite.
Considerando a composição da microbiota intestinal no intestino grosso, pacientes com perfuração colônica necessitam de cobertura antimicrobiana para bactérias gram-negativas e anaeróbias. Os organismos potencialmente infectantes em procedimentos colorretais são derivados do lúmen intestinal, Bacteroides fragilis e outros anaeróbios, bem como Enterobacteriaceae, como Escherichia coli, são as bactérias mais comuns.
Se houver qualquer sinal de um processo infeccioso em andamento, os antibióticos devem ser continuados. Uma TC abdominal é recomendada após 5 a 7 dias para excluir sinais residuais de peritonite ou formação de abscesso e para excluir a possível necessidade de intervenção cirúrgica.
Considerando a composição da microbiota intestinal no intestino grosso, pacientes com perfuração colônica necessitam de cobertura antimicrobiana para bactérias gram-negativas e anaeróbias. Os organismos potencialmente infectantes em procedimentos colorretais são derivados do lúmen intestinal, Bacteroides fragilis e outros anaeróbios, bem como Enterobacteriaceae, como Escherichia coli, são as bactérias mais comuns.
Se houver qualquer sinal de um processo infeccioso em andamento, os antibióticos devem ser continuados. Uma TC abdominal é recomendada após 5 a 7 dias para excluir sinais residuais de peritonite ou formação de abscesso e para excluir a possível necessidade de intervenção cirúrgica.
Qual é o tipo e a duração recomendados da profilaxia antitrombótica em pacientes submetidos a fechamento endoscópico bem-sucedido ou tratamento conservador da perfuração?
A sepse está associada à ativação da coagulação sanguínea (hipercoagulabilidade) contribuindo para o tromboembolismo venoso (TEV). Pacientes com sepse abdominal podem apresentar risco aumentado de TEV devido às suas condições pré-mórbidas, intervenção cirúrgica, admissão de diagnóstico de sepse e eventos e exposições como cateterismo venoso central, exames e procedimentos invasivos e drogas que potencializam a imobilidade.
Em pacientes com PIC submetidos a procedimento cirúrgico, a tromboprofilaxia geralmente é recomendada durante a internação e posteriormente de acordo com a doença de base e comorbidades (Grau de Recomendação 1B).
Em pacientes com PIC submetidos a procedimento cirúrgico, a tromboprofilaxia geralmente é recomendada durante a internação e posteriormente de acordo com a doença de base e comorbidades (Grau de Recomendação 1B).
Tratamento cirúrgico da perfuração colônica durante a colonoscopia
A cirurgia laparoscópica (laparoscopia exploradora) é mandatória no tratamento de pacientes com sinais de peritonite difusa e sepse, grandes perfurações, falha do tratamento conservador e na presença de algumas patologias concomitantes, como câncer colorretal ou pólipos não ressecados com alta suspeita de carcinoma.
A morbimortalidade perioperatória relacionada à cirurgia para perfuração colônica é considerável, com taxas de 21–44% e 7–25%, respectivamente. Pacientes particularmente frágeis, como idosos e com baixa pressão arterial pré-operatória (choque), têm maiores riscos de mortalidade. Assim, a seleção adequada de pacientes e procedimentos cirúrgicos são cruciais para limitar a morbimortalidade relacionada à cirurgia para perfuração colônica durante a colonoscopia.
Em geral, os achados intraoperatórios determinam a melhor técnica a ser aplicada de acordo com os diferentes cenários. Os procedimentos cirúrgicos incluem sutura da perfuração, ressecção em cunha, colostomia por exteriorização da perfuração e ressecção colônica com ou sem anastomose primária ou colostomia. A decisão quanto ao tipo de procedimento cirúrgico depende (a) do tamanho, localização e etiologia da perfuração; (b) a viabilidade do cólon e mesocólon circundantes; (c) o grau e o tempo de desenvolvimento da peritonite; (d) estado geral do paciente e presença de comorbidades; (e) a qualidade da preparação colônica; e (f) a presença de lesões residuais não ressecadas durante o procedimento de colonoscopia.
A decisão de qual procedimento realizar, portanto, depende de muitas variáveis, e deve ser feita após uma inspeção cuidadosa de todo o cólon e da cavidade abdominal. A laparoscopia permite visualizar o defeito na parede do cólon, seu tamanho e localização, principais fatores que influenciam a escolha do tratamento.
Se nenhuma lesão que exigiria ressecção cirúrgica for observada durante a colonoscopia, o tamanho da perfuração for pequeno e o cólon estiver saudável e bem perfundido, então um reparo primário laparoscópico pode ser realizado com segurança. Além disso, a exploração laparoscópica permite a aspiração e irrigação da cavidade peritoneal incluindo a coleta de material para cultura.
Para resumir, a laparoscopia exploratória é indicada para fins diagnósticos e terapêuticos, e dependendo da habilidade do cirurgião, existe potencial para procedimentos cirúrgicos definitivos, incluindo sutura do defeito, ressecção em cunha e ressecção segmentar com ou sem anastomose e/ou ostomia.
A laparoscopia exploratória tem uma morbidade e mortalidade significativamente menor em comparação com a laparotomia exploradora no cenário de emergência. A conversão de laparoscopia para laparotomia deve ser considerada sempre que necessário em relação à capacidade do operador de proceder laparoscopicamente, à viabilidade do tecido e ao estado do paciente (grau de recomendação 1C).
Recomendações:
No caso de câncer de cólon perfurado, a cirurgia deve seguir os princípios oncológicos da ressecção do câncer.
O controle de danos é uma técnica cirúrgica originalmente utilizada na cirurgia do trauma que consiste em três etapas: (1) uma laparotomia inicial abreviada com o objetivo de controlar a hemorragia e a contaminação com fechamento abdominal temporário (TAC); (2) ressuscitação até a melhora da fisiologia; e (3) retornar à sala de cirurgia após 24–72 h para reparo definitivo da lesão e fechamento da parede abdominal.
A perfuração não tratada ou mal diagnosticada quase sempre progride para peritonite e sepse, resultando em morbidade grave e prognóstico muito ruim. Notavelmente, taxas de morbidade de até 43% e taxas de mortalidade de até 25% foram relatadas. Quase um quarto dos pacientes receberá um diagnóstico tardio, com incidência de 45% de peritonite fecal. O processo inflamatório resultante associado à peritonite limita claramente as opções operatórias, impossibilitando um procedimento de estágio único e resultando em desvio fecal (colostomia) em 38% dos pacientes com peritonite fecal. Vários estudos relataram que idade > 67 anos, escore ASA, lesões contusas, mau preparo intestinal e esteroides são fatores de risco para aumento da morbidade pós-operatória.
A morbimortalidade perioperatória relacionada à cirurgia para perfuração colônica é considerável, com taxas de 21–44% e 7–25%, respectivamente. Pacientes particularmente frágeis, como idosos e com baixa pressão arterial pré-operatória (choque), têm maiores riscos de mortalidade. Assim, a seleção adequada de pacientes e procedimentos cirúrgicos são cruciais para limitar a morbimortalidade relacionada à cirurgia para perfuração colônica durante a colonoscopia.
Em geral, os achados intraoperatórios determinam a melhor técnica a ser aplicada de acordo com os diferentes cenários. Os procedimentos cirúrgicos incluem sutura da perfuração, ressecção em cunha, colostomia por exteriorização da perfuração e ressecção colônica com ou sem anastomose primária ou colostomia. A decisão quanto ao tipo de procedimento cirúrgico depende (a) do tamanho, localização e etiologia da perfuração; (b) a viabilidade do cólon e mesocólon circundantes; (c) o grau e o tempo de desenvolvimento da peritonite; (d) estado geral do paciente e presença de comorbidades; (e) a qualidade da preparação colônica; e (f) a presença de lesões residuais não ressecadas durante o procedimento de colonoscopia.
A decisão de qual procedimento realizar, portanto, depende de muitas variáveis, e deve ser feita após uma inspeção cuidadosa de todo o cólon e da cavidade abdominal. A laparoscopia permite visualizar o defeito na parede do cólon, seu tamanho e localização, principais fatores que influenciam a escolha do tratamento.
Se nenhuma lesão que exigiria ressecção cirúrgica for observada durante a colonoscopia, o tamanho da perfuração for pequeno e o cólon estiver saudável e bem perfundido, então um reparo primário laparoscópico pode ser realizado com segurança. Além disso, a exploração laparoscópica permite a aspiração e irrigação da cavidade peritoneal incluindo a coleta de material para cultura.
Para resumir, a laparoscopia exploratória é indicada para fins diagnósticos e terapêuticos, e dependendo da habilidade do cirurgião, existe potencial para procedimentos cirúrgicos definitivos, incluindo sutura do defeito, ressecção em cunha e ressecção segmentar com ou sem anastomose e/ou ostomia.
A laparoscopia exploratória tem uma morbidade e mortalidade significativamente menor em comparação com a laparotomia exploradora no cenário de emergência. A conversão de laparoscopia para laparotomia deve ser considerada sempre que necessário em relação à capacidade do operador de proceder laparoscopicamente, à viabilidade do tecido e ao estado do paciente (grau de recomendação 1C).
Recomendações:
- A melhor técnica cirúrgica para o manejo da PIC deve ser decidida após uma inspeção cuidadosa da cavidade abdominal e considerando a patologia colônica subjacente (grau de recomendação 2C).
- O reparo primário pode ser usado se os tecidos colônicos parecerem saudáveis e bem vascularizados, e uma aproximação das bordas da perfuração poder ser feita sem tensão (Grau de Recomendação 2C).
- A ressecção em cunha é viável se não implicar um estreitamento excessivo da luz do cólon (por exemplo, perfuração do ceco ou cólon sigmóide) (grau de recomendação 2C).
- A ressecção colônica está indicada se a perfuração for muito grande, as bordas parecerem desvitalizadas ou se houver avulsão do mesocólon adjacente (grau de recomendação 2C).
- Reparo com colostomia em estágios podem ser necessárias em casos de cirurgia tardia (> 24 h da colonoscopia), contaminação peritoneal extensa, comorbidades importantes ou deterioração do estado geral do paciente (ou seja, hemodinamicamente instável ou sepse) (Grau de recomendação 2C).
No caso de câncer de cólon perfurado, a cirurgia deve seguir os princípios oncológicos da ressecção do câncer.
O controle de danos é uma técnica cirúrgica originalmente utilizada na cirurgia do trauma que consiste em três etapas: (1) uma laparotomia inicial abreviada com o objetivo de controlar a hemorragia e a contaminação com fechamento abdominal temporário (TAC); (2) ressuscitação até a melhora da fisiologia; e (3) retornar à sala de cirurgia após 24–72 h para reparo definitivo da lesão e fechamento da parede abdominal.
A perfuração não tratada ou mal diagnosticada quase sempre progride para peritonite e sepse, resultando em morbidade grave e prognóstico muito ruim. Notavelmente, taxas de morbidade de até 43% e taxas de mortalidade de até 25% foram relatadas. Quase um quarto dos pacientes receberá um diagnóstico tardio, com incidência de 45% de peritonite fecal. O processo inflamatório resultante associado à peritonite limita claramente as opções operatórias, impossibilitando um procedimento de estágio único e resultando em desvio fecal (colostomia) em 38% dos pacientes com peritonite fecal. Vários estudos relataram que idade > 67 anos, escore ASA, lesões contusas, mau preparo intestinal e esteroides são fatores de risco para aumento da morbidade pós-operatória.
Acompanhamento após o tratamento com sucesso da perfuração cólica durante a colonoscopia
Existe alguma recomendação para realizar uma endoscopia de vigilância após o sucesso do tratamento da perfuração? Se houver, qual o tempo recomendado para isso?
Atualmente, não há estudos na literatura com foco nas indicações e no momento da endoscopia de vigilância após o tratamento bem-sucedido da perfuração. No entanto, com base nas evidências disponíveis e na experiência clínica, uma colonoscopia de vigilância pode ser realizada com base na indicação inicial (p. e considerando a relação risco-benefício da realização de um exame endoscópico.
Assim, em casos de perfuração durante uma colonoscopia cirúrgica (por exemplo, polipectomia, ressecção endoscópica da mucosa ou dissecção endoscópica da submucosa), uma colonoscopia de vigilância deve ser realizada de acordo com as diretrizes atuais para determinar se a ressecção durante a endoscopia primária foi completa.
A colonoscopia é especificamente contraindicada em casos de perfuração conhecida ou suspeita. Consequentemente, qualquer colonoscopia após o tratamento da perfuração deve ser realizada uma vez que a parede do cólon esteja completamente curada. Supondo que o tempo de cicatrização após o tratamento da perfuração seja comparável ao após suturas cirúrgicas ou anastomose, uma colonoscopia de vigilância pode ser indicada após aproximadamente 3 a 6 meses do tratamento bem-sucedido da perfuração, dependendo do tamanho da perfuração e do tipo de reparo.
Em geral, antes de qualquer colonoscopia de vigilância, é necessário reavaliar cuidadosamente a presença de condições específicas que favorecem a perfuração, incluindo aumento da idade, sexo feminino, baixo IMC, internação em unidade de terapia intensiva, internação, doença diverticular, doença de Crohn doença, obstrução como indicação para a colonoscopia primária e colonoscopia intervencionista invasiva. De fato, a colonoscopia é contraindicada sempre que os riscos para a saúde ou a vida do paciente superam os benefícios mais favoráveis do procedimento.
Atualmente, não há estudos na literatura com foco nas indicações e no momento da endoscopia de vigilância após o tratamento bem-sucedido da perfuração. No entanto, com base nas evidências disponíveis e na experiência clínica, uma colonoscopia de vigilância pode ser realizada com base na indicação inicial (p. e considerando a relação risco-benefício da realização de um exame endoscópico.
Assim, em casos de perfuração durante uma colonoscopia cirúrgica (por exemplo, polipectomia, ressecção endoscópica da mucosa ou dissecção endoscópica da submucosa), uma colonoscopia de vigilância deve ser realizada de acordo com as diretrizes atuais para determinar se a ressecção durante a endoscopia primária foi completa.
A colonoscopia é especificamente contraindicada em casos de perfuração conhecida ou suspeita. Consequentemente, qualquer colonoscopia após o tratamento da perfuração deve ser realizada uma vez que a parede do cólon esteja completamente curada. Supondo que o tempo de cicatrização após o tratamento da perfuração seja comparável ao após suturas cirúrgicas ou anastomose, uma colonoscopia de vigilância pode ser indicada após aproximadamente 3 a 6 meses do tratamento bem-sucedido da perfuração, dependendo do tamanho da perfuração e do tipo de reparo.
Em geral, antes de qualquer colonoscopia de vigilância, é necessário reavaliar cuidadosamente a presença de condições específicas que favorecem a perfuração, incluindo aumento da idade, sexo feminino, baixo IMC, internação em unidade de terapia intensiva, internação, doença diverticular, doença de Crohn doença, obstrução como indicação para a colonoscopia primária e colonoscopia intervencionista invasiva. De fato, a colonoscopia é contraindicada sempre que os riscos para a saúde ou a vida do paciente superam os benefícios mais favoráveis do procedimento.
A síndrome pós-polipectomia (também conhecida como síndrome de coagulação pós-polipectomia, síndrome de eletrocoagulação pós-polipectomia e síndrome de queimadura transmural) refere-se ao desenvolvimento de dor abdominal localizada, febre e leucocitose (aumento dos leucócitos no sangue) na ausência de perfuração intestinal após a retirada de pólipos com eletrocautério.
O reconhecimento da síndrome pós-polipectomia é importante para evitar cirurgia desnecessária, uma vez que o tratamento clínico é eficaz em quase todos os pacientes. Ocorre em menos de 0,5% das colonoscopias com retirada de pólipos com eletrocautério.
Fatores associados ao risco aumentado da síndrome pós-polipectomia :
ᴥ» Tamanho do pólipo - Quanto maior o pólipo (≥ 10 mm), maior o risco da síndrome;
ᴥ» Forma do pólipo – Lesão não polipóide, maior risco da síndrome;
ᴥ» Localização da lesão - Lesões no cólon ascendente e no ceco parecem ter taxas mais altas de complicações, incluindo a síndrome pós-polipectomia, e isso se deve a espessura da parede intestinal ser mais finar;
ᴥ» Pacientes com hipertensão arterial - O risco é maior nos pacientes hipertensos.
Algumas técnicas endoscópicas podem reduzir o risco da síndrome pós-polipectomia:
ᴥ» Tracionar o pólipo em direção ao centro da luz, imediatamente antes da aplicação do eletrocautério, para que a mucosa seja afastada do restante da parede intestinal;
ᴥ» Injetar solução na submucosa para pólipos ≥ 10 mm;
ᴥ» Usar com mais frequência a polipectomia com alça a frio, isto é, sem usar o eletrocautério. Dados disponíveis sugerem ser uma opção segura e eficaz, mesmo para pólipos > 10 mm, localizadas no cólon direito e ceco.
Apresentação clínica da síndrome pós-polipectomia
Tipicamente apresentam sintomas nas próximas 12 horas após a colonoscopia, mas podem ocorrer até sete dias depois. A maioria dos pacientes apresenta dor abdominal generalizada ou localizada na região do local da polipectomia. Febre e/ou taquicardia também podem estar presentes. O exame abdominal pode revelar sensibilidade abdominal localizada no local da polipectomia, mas alguns podem apresentar sinais e sintomas semelhantes a perfuração intestinal.
Diagnóstico da síndrome pós-polipectomia
Deve-se suspeitar da síndrome pós-polipectomia nos pacientes que apresentam dor e sensibilidade abdominal após a polipectomia com eletrocautério, particularmente após a remoção de pólipo grande (ou seja, ≥ 10 mm). Pode ser acompanhada por febre, taquicardia e leucocitose.
A tomografia computadorizada do abdome e da pelve (com contraste oral solúvel em água e contraste intravenoso) exclui a perfuração do cólon (ausência de ar livre no abdome). Podem ter espessamento focal da parede do cólon e/ou alteração da densidade da gordura em torno do cólon.
Para pacientes selecionados (por exemplo, aqueles com dor abdominal localizada leve, sem febre e sem taquicardia), pode ser razoável fazer o diagnóstico com base na apresentação clínica e sem exames complementares.
Tratamento ambulatorial da síndrome pós-polipectomia
Pacientes selecionados podem ser tratados em regime ambulatorial desde que todas as condições a seguir forem atendidas:
ᴥ» Dor abdominal leve.
ᴥ» Pressão arterial, frequência cardíaca e respiratória normais e afebril.
ᴥ» Tomografia computadorizada abdominal e pélvica não mostra sinais de perfuração ou outras complicações graves.
Consiste no antibiótico oral por sete dias e uma dieta sem resíduos. Os pacientes são reavaliados clinicamente em dois a três dias. Se os sintomas melhorarem (por exemplo, sem dor abdominal ou febre), a dieta livre é liberada. Se a condição do paciente não melhorar ou piorar, a internação é necessária.
Antibiótico Oral. A queimadura da parede intestinal pode causar ruptura na barreira de defesa. Devem cobrir a flora gastrointestinal usual, bastonetes gram-negativos e anaeróbios.
ᴥ» Ciprofloxacino (500 mg de 12/12 horas) com metronidazol (500 mg de 8/8 horas).
ᴥ» Levofloxacino (750 mg ao dia) com metronidazol (500 mg de 8/8 horas).
ᴥ» Amoxicillina-clavulanato (875 mg amoxicillina e 125 mg clavulanato) de 8/8 horas.
Dieta. Dieta sem resíduos até que possam ser reavaliados em dois ou três dias. A dieta pode então ser liberada para uma dieta regular se melhorar clinicamente (sem dor ou sensibilidade abdominal).
O tratamento hospitalar da síndrome pós-polipectomia é necessário para os demais pacientes.
A dieta depende da gravidade dos sintomas, jejum (repouso intestinal completo) ou dieta sem resíduos. Caso a dor abdominal desapareça em dois a três dias a dieta é progredida.
Antibióticos venosos. A escolha depende da gravidade da doença.
Metronidazol 500 mg IV cada 8 horas + Ceftriaxona 2g IV uma vez ao dia ou Cefotaxima 2g IV a cada 8 horas ou Ciprofloxacina 400 mg IV a cada 12 horas ou Levofloxacina 750 mg IV uma vez ao dia.
Os antibióticos intravenosos devem ser continuados até que a dor abdominal desapareça, geralmente de dois a três dias, quando troca para antibióticos orais (por exemplo, ciprofloxacina com metronidazol ou monoterapia com amoxicilina-clavulanato), para completar um curso de sete.
Pacientes com melhora clínica podem receber alta com antibióticos orais para completar um curso de sete dias. Critérios para a alta hospitalar:
ᴥ» Normalização dos sinais vitais (isto é, resolução da febre, taquicardia e normalização da pressão arterial).
ᴥ» Resolução de dor abdominal.
ᴥ» Tolerância a dieta oral.
Pacientes com síndrome pós-polipectomia que não melhoram ou pioram (por exemplo, aumento da dor abdominal ou leucocitose, ou desenvolvimento de peritonite difusa), é urgente a avaliação da cirurgia e nova tomografia computadorizada do abdome e da pelve é feita.
Se houver suspeita de perfuração do cólon com base no exame clínico (por exemplo, defesa abdominal e rigidez) e/ou exames de imagem mostrando ar extraluminal, o tratamento é direcionado para a perfuração do cólon.
O reconhecimento da síndrome pós-polipectomia é importante para evitar cirurgia desnecessária, uma vez que o tratamento clínico é eficaz em quase todos os pacientes. Ocorre em menos de 0,5% das colonoscopias com retirada de pólipos com eletrocautério.
Fatores associados ao risco aumentado da síndrome pós-polipectomia :
ᴥ» Tamanho do pólipo - Quanto maior o pólipo (≥ 10 mm), maior o risco da síndrome;
ᴥ» Forma do pólipo – Lesão não polipóide, maior risco da síndrome;
ᴥ» Localização da lesão - Lesões no cólon ascendente e no ceco parecem ter taxas mais altas de complicações, incluindo a síndrome pós-polipectomia, e isso se deve a espessura da parede intestinal ser mais finar;
ᴥ» Pacientes com hipertensão arterial - O risco é maior nos pacientes hipertensos.
Algumas técnicas endoscópicas podem reduzir o risco da síndrome pós-polipectomia:
ᴥ» Tracionar o pólipo em direção ao centro da luz, imediatamente antes da aplicação do eletrocautério, para que a mucosa seja afastada do restante da parede intestinal;
ᴥ» Injetar solução na submucosa para pólipos ≥ 10 mm;
ᴥ» Usar com mais frequência a polipectomia com alça a frio, isto é, sem usar o eletrocautério. Dados disponíveis sugerem ser uma opção segura e eficaz, mesmo para pólipos > 10 mm, localizadas no cólon direito e ceco.
Apresentação clínica da síndrome pós-polipectomia
Tipicamente apresentam sintomas nas próximas 12 horas após a colonoscopia, mas podem ocorrer até sete dias depois. A maioria dos pacientes apresenta dor abdominal generalizada ou localizada na região do local da polipectomia. Febre e/ou taquicardia também podem estar presentes. O exame abdominal pode revelar sensibilidade abdominal localizada no local da polipectomia, mas alguns podem apresentar sinais e sintomas semelhantes a perfuração intestinal.
Diagnóstico da síndrome pós-polipectomia
Deve-se suspeitar da síndrome pós-polipectomia nos pacientes que apresentam dor e sensibilidade abdominal após a polipectomia com eletrocautério, particularmente após a remoção de pólipo grande (ou seja, ≥ 10 mm). Pode ser acompanhada por febre, taquicardia e leucocitose.
A tomografia computadorizada do abdome e da pelve (com contraste oral solúvel em água e contraste intravenoso) exclui a perfuração do cólon (ausência de ar livre no abdome). Podem ter espessamento focal da parede do cólon e/ou alteração da densidade da gordura em torno do cólon.
Para pacientes selecionados (por exemplo, aqueles com dor abdominal localizada leve, sem febre e sem taquicardia), pode ser razoável fazer o diagnóstico com base na apresentação clínica e sem exames complementares.
Tratamento ambulatorial da síndrome pós-polipectomia
Pacientes selecionados podem ser tratados em regime ambulatorial desde que todas as condições a seguir forem atendidas:
ᴥ» Dor abdominal leve.
ᴥ» Pressão arterial, frequência cardíaca e respiratória normais e afebril.
ᴥ» Tomografia computadorizada abdominal e pélvica não mostra sinais de perfuração ou outras complicações graves.
Consiste no antibiótico oral por sete dias e uma dieta sem resíduos. Os pacientes são reavaliados clinicamente em dois a três dias. Se os sintomas melhorarem (por exemplo, sem dor abdominal ou febre), a dieta livre é liberada. Se a condição do paciente não melhorar ou piorar, a internação é necessária.
Antibiótico Oral. A queimadura da parede intestinal pode causar ruptura na barreira de defesa. Devem cobrir a flora gastrointestinal usual, bastonetes gram-negativos e anaeróbios.
ᴥ» Ciprofloxacino (500 mg de 12/12 horas) com metronidazol (500 mg de 8/8 horas).
ᴥ» Levofloxacino (750 mg ao dia) com metronidazol (500 mg de 8/8 horas).
ᴥ» Amoxicillina-clavulanato (875 mg amoxicillina e 125 mg clavulanato) de 8/8 horas.
Dieta. Dieta sem resíduos até que possam ser reavaliados em dois ou três dias. A dieta pode então ser liberada para uma dieta regular se melhorar clinicamente (sem dor ou sensibilidade abdominal).
O tratamento hospitalar da síndrome pós-polipectomia é necessário para os demais pacientes.
A dieta depende da gravidade dos sintomas, jejum (repouso intestinal completo) ou dieta sem resíduos. Caso a dor abdominal desapareça em dois a três dias a dieta é progredida.
Antibióticos venosos. A escolha depende da gravidade da doença.
Metronidazol 500 mg IV cada 8 horas + Ceftriaxona 2g IV uma vez ao dia ou Cefotaxima 2g IV a cada 8 horas ou Ciprofloxacina 400 mg IV a cada 12 horas ou Levofloxacina 750 mg IV uma vez ao dia.
Os antibióticos intravenosos devem ser continuados até que a dor abdominal desapareça, geralmente de dois a três dias, quando troca para antibióticos orais (por exemplo, ciprofloxacina com metronidazol ou monoterapia com amoxicilina-clavulanato), para completar um curso de sete.
Pacientes com melhora clínica podem receber alta com antibióticos orais para completar um curso de sete dias. Critérios para a alta hospitalar:
ᴥ» Normalização dos sinais vitais (isto é, resolução da febre, taquicardia e normalização da pressão arterial).
ᴥ» Resolução de dor abdominal.
ᴥ» Tolerância a dieta oral.
Pacientes com síndrome pós-polipectomia que não melhoram ou pioram (por exemplo, aumento da dor abdominal ou leucocitose, ou desenvolvimento de peritonite difusa), é urgente a avaliação da cirurgia e nova tomografia computadorizada do abdome e da pelve é feita.
Se houver suspeita de perfuração do cólon com base no exame clínico (por exemplo, defesa abdominal e rigidez) e/ou exames de imagem mostrando ar extraluminal, o tratamento é direcionado para a perfuração do cólon.
Isenção de responsabilidade
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.