Probióticos no Tratamento de Doenças Intestinais
Probióticos - Introdução
O que são Probióticos? O que significa probióticos?
Mecanismos de ação dos probióticos
Uso concomitante de probióticos na prevenção da diarreia causada pelos antibióticos
Uso concomitante de probióticos na prevenção da diarreia causada pelo C. difficile associado ao uso de antibióticos
Uso concomitante de probióticos como parte do tratamento da diarreia causada pelo C. difficile associado ao uso de antibióticos
Uso de probióticos na gastroenterite infecciosa aguda (diarreia infecciosa) para reduzir a duração ou a gravidade da diarreia
Uso de probióticos na doença de Crohn para indução ou manutenção da remissão
Uso de probióticos na colite ulcerativa para indução ou manutenção da remissão
Uso de probióticos na bolsite da colite ulcerativa para prevenção ou manutenção da remissão
Uso de probióticos na colite diverticular para tratamento e prevenção da recorrência
Uso de probióticos na enterite por radiação como parte do tratamento e prevenção da recorrência
Uso de probióticos na síndrome do intestino irritável como parte do tratamento para melhorar a gravidade dos sintomas
Uso de probióticos na diarreia provocada pela quimioterapia do câncer para ajudar na prevenção e tratamento
As interações entre os microrganismos intestinais e o hospedeiro são objeto de intensa pesquisa em andamento, pois podem influenciar uma variedade de doenças. Parte desta pesquisa envolve a manipulação deliberada da microbiota intestinal com intenção terapêutica. A maior experiência tem sido nas doenças inflamatórias intestinais (colite ulcerativa, doença de Crohn e bolsite) e síndrome do intestino irritável, embora estejam surgindo ensaios clínicos em várias outras condições.
Existem quatro mecanismos pelos quais a microbiota intestinal pode ser alterada: administração de antibióticos, dietas terapêuticas e prebióticos (ou seja, componentes dietéticos que promovem o crescimento e atividade metabólica de bactérias benéficas), probióticos (ou seja, bactérias benéficas) ou transplante microbiota fecal (TMF). A combinação desses métodos também é possível (simbióticos – prebióticos com probióticos).
Estudos recentes demonstraram que a restauração das espécies bacterianas comensais protetoras, que estão diminuídos em certos distúrbios, acarretam benefícios ao tratamento de determinados distúrbios intestinais.
Estudos de espécies probióticas selecionadas (administradas isoladamente ou em combinação) demonstraram eficácia em várias doenças intestinais, das quais as mais bem estudadas são as doenças inflamatórias intestinais. O benefício terapêutico também é sugerido em vários outros distúrbios, incluindo diarreia relacionada a antibióticos, colite induzida por toxina do Clostridioides difficile, diarreia infecciosa, encefalopatia hepática, síndrome do intestino irritável e alergia.
Os prebióticos não são iguais aos probióticos. Os prebióticos são componentes alimentares não digeríveis que estimulam seletivamente o crescimento ou a atividade de microrganismos desejáveis. Os simbióticos são produtos que combinam probióticos e prebióticos.
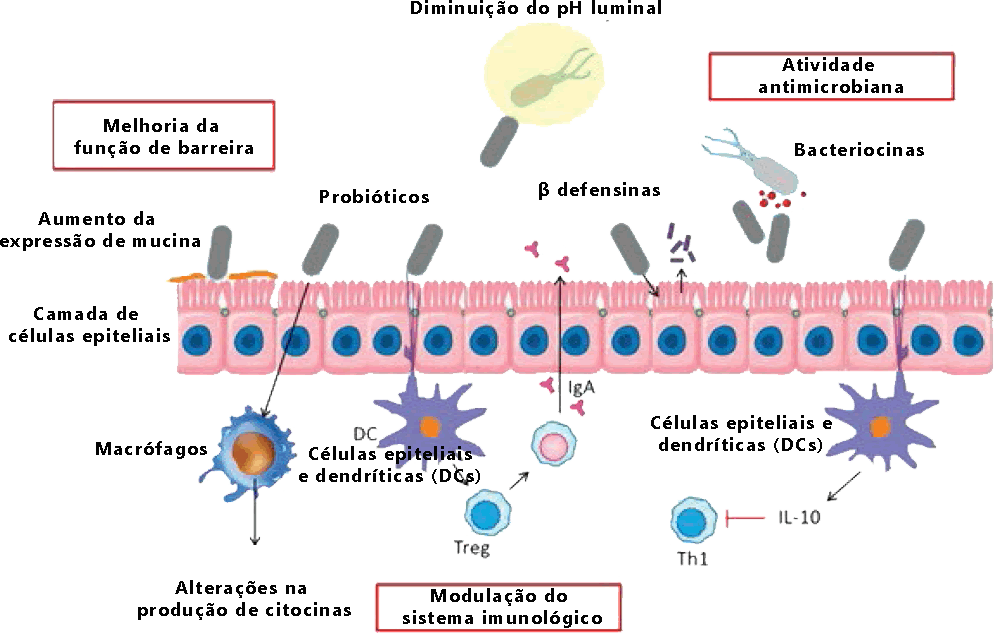
(1) Melhoria da função da barreira intestinal.
(2) Modulação do sistema imunológico.
(3) Atividade antimicrobiana. Supressão do crescimento ou ligação/invasão da mucosa por bactérias patogênicas.
(1) Melhoria da função de barreira: os probióticos são capazes de influenciar muitos dos componentes da função de barreira epitelial, seja pela indução da secreção de mucina, manutenção ou aumento da fosforilação de proteínas do citoesqueleto e da junção estreita, restauração da secreção de cloreto e aumento da secreção transepitelial. resistência. Estudos mostraram que eles iniciam o reparo da função de barreira após o dano
(2) Atividades antimicrobianas dos probióticos: diminuição do pH luminal, o bloqueio da aderência e translocação bacteriana, ou a secreção de substâncias antibacterianas e defensina. Eles também competem com as bactérias patogênicas por locais de ligação às células epiteliais e à camada de muco sobrejacente.
(3) Imunomodulação: as bactérias probióticas têm a capacidade de interagir com células epiteliais e dendríticas (DCs) e com monócitos/macrófagos e linfócitos exercendo assim efeito imunomodulador.
No entanto, na maioria dos casos, ainda não sabemos quais probióticos são úteis e quais não são. Também não sabemos a dose probiótica ou quem teria maior probabilidade de se beneficiar. Mesmo para as condições mais estudadas, os pesquisadores ainda estão trabalhando para encontrar as respostas para essas perguntas.
Os probióticos diferem em sua capacidade de resistir ao ácido gástrico e aos ácidos biliares, colonizar o trato intestinal e influenciar as citocinas secretadas pelas células epiteliais intestinais. Assim, nem todos os probióticos são iguais; como resultado, os benefícios observados clinicamente com uma espécie ou com uma combinação de espécies não são necessariamente aplicáveis para outras cepas.
Embora o iogurte seja frequentemente recomendado como fonte de probióticos, nem todas as bactérias contidas no iogurte sobrevivem no ambiente ácido do estômago ou colonizam a mucosa intestinal de forma eficiente. Além disso, a lactose residual contida no iogurte pode aumentar os sintomas em pacientes com intolerância à lactose, incluindo aqueles que desenvolvem intolerância transitória à lactose secundária a uma gastroenterite (um cenário em que os probióticos têm sido recomendados).
Bebidas lácteas fermentadas, como o kefir, contêm concentrações muito mais altas de probióticos vivos do que iogurte e são relativamente resistentes ao ácido gástrico.
Está ficando cada vez mais claro que o efeito de uma cepa probiótica não pode ser extrapolado para todos os probióticos e, de fato, o efeito biológico dos probióticos é específico da espécie e da cepa.
Em pessoas que não foram hospitalizadas, usar probióticos junto com antibióticos acarreta uma diminuição significativa, cerca de metade, na probabilidade de diarreia não causada pelo C. difficile associada a antibióticos. Portando os probióticos são protetores. Os pacientes que receberam probióticos não apresentaram mais efeitos colaterais do que os pacientes que não receberam.
A levedura Saccharomyces boulardi foi o único probiótico que isoladamente demonstrou um efeito significativo na redução da incidência de diarreia associado ao uso de antibiótico.
Probiótico – cepa única
Saccharomyces boulardii 100mg e 200mg
Probióticos – cepas combinadas
Lactobacillus casei 109 UFC,
Lactobacillus acidophilus 109 UFC,
Lactococcus lactis 109 UFC,
Bifidobacterium bifidum 109 UFC,
Bifidobacterium lactis 109 UFC
Simbiótico
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
A justificativa para o uso de probióticos junto com antibióticos é acelerar a recuperação de uma microbiota intestinal comprometida impedindo que patógenos oportunistas sejam capazes de ocupar os sítios abertos devido ao uso de antibióticos.
A levedura Saccharomyces boulardi foi o único probiótico que isoladamente demonstrou um efeito significativo na redução da incidência de diarreia associado ao uso de antibiótico.
Probiótico – cepa única
Saccharomyces boulardii 100mg e 200mg
Probióticos – cepas combinadas
Lactobacillus casei 109 UFC,
Lactobacillus acidophilus 109 UFC,
Lactococcus lactis 109 UFC,
Bifidobacterium bifidum 109 UFC,
Bifidobacterium lactis 109 UFC
Simbiótico
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
Não é recomendado a administração coadjuvante de probióticos no tratamento da infecção pelo C. difficile, de acordo com as diretrizes atuais. As limitações dos dados disponíveis incluem diferenças nas formulações probióticas estudadas, duração da administração de probióticos, definições da infecção pelo C. difficile, duração do acompanhamento do estudo e inclusão de pacientes.
Os probióticos mais estudados são o S boulardii e o L rhamnosus e ambos, mesmo quando usados isoladamente, são capazes de reduzir a duração média da diarreia para quase a metade quando comparados com placebo, mas não revelaram diferença entre probiótico e placebo em termos de frequência média das evacuações no segundo dia da doença, taxas de infecção grave ou taxas de hospitalização.
Das terapias probióticas combinadas, a mais testada foi a combinação do L acidophilus e B bifidum. Essa combinação pode reduzir a duração média da diarreia.
Os probióticos provavelmente têm múltiplos mecanismos de ação no intestino que podem incluir efeitos na imunidade do hospedeiro e na integridade da barreira da mucosa intestinal, bem como efeitos contra patógenos diarreicos.
Como a maioria dos episódios de diarreia aguda não é complicada, é autolimitada e não requer tratamento específico, as análises de custo-efeito precisam determinar se os probióticos devem ser usados em grupos específicos de pessoas.
Probiótico – cepa única
Saccharomyces boulardii 100mg ou 200mg
Probiótico – cepa única
Lactobacillus rhamnosus
Simbiótico
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
As atuais estratégias de tratamento das DIIs baseiam-se principalmente no controle do sistema imunológico, embora haja um foco crescente em terapias direcionadas à microbiota. Alterações do microbioma intestinal foram bem descritas nas DIIs tanto na composição quanto na função, mas ainda não está claro se elas desencadeariam ou perpetuariam a inflamação subjacente ou simplesmente seria resultado das alterações na mucosa causadas pela DII.
As alterações da microbiota são particularmente bem descritas na doença de Crohn, uma forma recidivante e remitente (sintomas que transitoriamente reduzem a sua intensidade) de DII caracterizada por lesões segmentares, descontínuas, assimétricas e transmurais em todo o trato gastrointestinal; por complicações cirúrgicas frequentes, incluindo estenoses, fístulas e abscessos; e por manifestações extra-intestinais.
Atualmente, não há evidências que sugiram que os probióticos sejam benéficos para a indução ou manutenção da remissão em crianças ou adultos com doença de Crohn. Nenhum dos estudos relatou um benefício significativo da terapia probiótica. Estudos maiores são necessários para determinar se os probióticos podem ser benéficos na doença de Crohn. Da mesma forma, o uso de probióticos na prevenção da recorrência pós-operatória da doença de Crohn não teve sucesso.
Embora o uso de probióticos seja considerada segura, a toxicidade pode ocorrer no contexto de imunossupressão e aumento da permeabilidade da mucosa com risco de sepse.
A colite ulcerativa é uma forma crônica de DII caracterizada por inflamação da mucosa que tipicamente se estende proximalmente a partir do reto; como na doença de Crohn, manifestações extra-intestinais são comuns. As atuais estratégias de tratamento das DIIs baseiam-se principalmente no controle do sistema imunológico. Semelhante à doença de Crohn, alterações no microbioma intestinal foram descritas na colite ulcerativa, assim terapias direcionadas ao microbioma, incluindo probióticos e, mais recentemente, transplante de microbiota fecal, poderia ser benéfica.
Em pacientes com colite leve a moderada a terapia convencional combinada com um probiótico não parece melhorar as taxas gerais de remissão, embora haja evidências limitadas de que os probióticos possam proporcionar benefícios modestos em termos de redução da atividade da doença.
Em pacientes com colite grave a eficácia dos probióticos permanece desconhecida. A formulação combinando 8 cepas (L paracasei, L plantarum, L acidophilus, L delbrueckii, B longum, B breve, B longum infantis e S salivarius) demonstrou potencial benefício.
A adição de probióticos, prebióticos ou simbióticos ao tratamento convencional pode ser útil para induzir ou manter a remissão da doença. Mas a recomendação geral em todos os trabalhos com probióticos para indução ou manutenção da remissão na colite ulcerativa é baixa.
Embora o uso de probióticos seja considerada segura, a toxicidade pode ocorrer no contexto de imunossupressão e aumento da permeabilidade da mucosa com risco de sepse.
Simbiótico 1
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
Simbiótico 2
Lactobacillus acidophilus 109 UFC
Lactobacillus. rhamnosus 109 UFC
Lactobacillus paracasei 109 UFC
Bifidobacterium lactis 109 UFC
Frutooligossacarídeo 5,5 g
A complicação a longo prazo mais frequentemente observada da IPAA é a inflamação aguda e/ou crônica do reservatório ileal, denominada bolsite. Os sintomas da bolsite incluem aumento da frequência das evacuações, urgência, sangramento anal, dor abdominal, febre e manifestações extra-intestinais da colite ulcerativa.
A bolsite afeta aproximadamente 20 por cento dos pacientes com colite ulcerativa no primeiro ano após a cirurgia e 50 por cento dos pacientes após cinco anos, mas menos de 1 por cento dos pacientes com colectomias para tratar a polipose familiar.
Estudos demonstraram alterações na microbiota em pacientes com bolsite e a alta taxa de resposta a vários antibióticos suportam um papel importante das bactérias na patogênese da bolsite e fornecem uma justificativa para ensaios clínicos destinados a alterar a microbiota com probióticos.
Quatro estudos publicados examinaram a combinação de 8 cepas de L paracasei, L plantarum, L acidophilus, L delbrueckii subsp bulgaricus, B longum subsp longum, B breve, B longum subsp infantis e S salivarius subsp thermophilus para adultos com IPAA no cenário de colite ulcerativa crônica. Esses estudos revelaram um benefício potencial para adultos com colite ulcerativa e IPAA, tanto na prevenção de um primeiro episódio de bolsite aguda quanto na manutenção da remissão após o tratamento para bolsite.
Não está claro se outras formulações ou combinações de probióticos teriam efeitos benéficos semelhantes na bolsite, uma vez que nenhuma outra formulação foi testada com tanto rigor. Também não está claro se um benefício potencial pode existir para pacientes com IPAA resultante de polipose adenomatosa familiar ou outros distúrbios intestinais.
Simbiótico 1
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
Simbiótico 2
Lactobacillus acidophilus 109 UFC
Lactobacillus. rhamnosus 109 UFC
Lactobacillus paracasei 109 UFC
Bifidobacterium lactis 109 UFC
Frutooligossacarídeo 5,5 g
A colite segmentar associada à diverticulose (SCAD) geralmente é diagnosticada incidentalmente durante a avaliação de diarreia crônica e/ou dor abdominal. O diagnóstico é feito pela presença de inflamação na colonoscopia e alterações inflamatórias crônicas na biópsia em segmento do cólon com divertículos na ausência de inflamação no reto.
O tratamento inicial é realizado com antibióticos: ciprofloxacina 500 mg por via oral duas vezes ao dia e metronidazol 10 mg/kg por dia em duas ou três doses divididas por 10 a 14 dias. Em pacientes que não respondem aos antibióticos orais, adiciona mesalamina oral (800 mg por via oral três vezes ao dia por 7 a 10 dias), e se a resposta for inadequada em duas a quatro semanas, aumentamos a dose para 1600 mg por via oral três vezes diário. Nos pacientes que não respondem aos antibióticos e mesalamina, associa-se a prednisona 40 mg diariamente por uma semana, reduzindo gradualmente a dose com suspensão em seis semanas.
A terapia combinada com 8 cepas de L paracasei, L plantarum, L acidophilus, L delbrueckii subsp bulgaricus, B longum subsp longum, B breve, B longum subsp infantis e S salivarius subsp thermophilus foi benéfica na associação com o tratamento acima em uma série de casos. Não está claro se outras formulações ou combinações de probióticos teriam efeitos benéficos semelhantes.
Simbiótico 1
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
Simbiótico 2
Lactobacillus acidophilus 109 UFC
Lactobacillus. rhamnosus 109 UFC
Lactobacillus paracasei 109 UFC
Bifidobacterium lactis 109 UFC
Frutooligossacarídeo 5,5 g
Uma meta-análise de seis ensaios clínicos randomizados de probióticos na diarreia induzida por radiação detectou um ligeiro benefício geral na diarreia, mas nenhuma diferença nas escalas de fezes de Bristol ou no uso de mediação antidiarreica. Os resultados dos estudos individuais foram variáveis. A pesquisa básica indica que as bactérias intestinais contribuem para lesões e reparos induzidos por radiação, portanto, a aplicação terapêutica está aberta à investigação.
O critério de Roma IV: dor e/ou desconforto abdominal recorrente, pelo menos um dia por semana nos últimos três meses, associado a dois ou mais dos seguintes critérios:
- Associado ao alívio dos sintomas com a evacuação;
- Associado a alteração na frequência da evacuação (diarreia e/ou constipação);
- Associado a alteração na forma e/ou aparência das fezes.
A prevalência da síndrome do intestino irritável (SII), estimada a partir de estudos populacionais, é de aproximadamente 10 a 15%. A prevalência da SII é 25% menor em indivíduos acima de 50 anos em comparação com os mais jovens. A prevalência geral da SII em mulheres é maior em comparação com homens,14 e 9%, respectivamente.
A fisiopatologia da SII é incompletamente compreendida e incluem alteração da motilidade gastrointestinal, alteração da microbiota intestinal e comunicação anormal entre o intestino e o cérebro.
Vários estudos mostraram diferenças na composição da microbiota intestinal entre pacientes com SII e controles saudáveis, sendo a diminuição da diversidade a mais frequente. No entanto, uma observação semelhante foi feita em outras condições crônicas, sugerindo que esse achado não é específico da SII. A falta de mecanismos conhecidos pelos quais os probióticos podem melhorar os sintomas da SII não impede o seu uso, que é bastante prevalente entre os médicos.
Os probióticos de cepa única não mostraram benefício significativo nos escores globais de sintomas ou dor abdominal.
Os probióticos combinando várias cepas são eficazes na SII, tanto em termos de melhora nos sintomas gerais quanto nos escores de sintomas globais, dor abdominal, inchaço e flatulência, particularmente aqueles com sintomas predominantes de diarreia.
Os probióticos também são eficazes para a SII-Constipação, em termos de melhora na frequência das evacuações, consistência das fezes, tempo de trânsito intestinal, evacuação completa, inchaço e flatulência.
A duração do tratamento nos trabalhos varia, mas a maioria recomenda um mínimo de 4 semanas, podendo se prolongar por até 12 semanas. Novos estudos são necessários para determinar se os probióticos mantém o efeito na melhora dos sintomas da SII quando usados por mais de 12 semanas.
As duas famílias de probióticos mais comumente administradas no tratamento da SII-Diarreia e SII-Constipação são dos gêneros Lactobacillus e Bifidobacterium. Estudos são necessários para determinar quais as melhores espécies ou cepas probióticas, doses e duração.
Probióticos – cepas combinadas
Lactobacillus casei 109 UFC,
Lactobacillus acidophilus 109 UFC,
Lactococcus lactis 109 UFC,
Bifidobacterium bifidum 109 UFC,
Bifidobacterium lactis 109 UFC
Simbiótico 1
Lactobacillus acidophilus 109 UFC,
Lactobacillus rhamnosus 109 UFC
Bifidobacterium bifidum 109 UFC,
Frutooligossacarídeo 5,5 g
Simbiótico 2
Lactobacillus acidophilus 109 UFC
Lactobacillus. rhamnosus 109 UFC
Lactobacillus paracasei 109 UFC
Bifidobacterium lactis 109 UFC
Frutooligossacarídeo 5,5 g
O uso diário de probióticos antes ou durante a quimioterapia pode prevenir a ocorrência de diarreia e mucosite oral provocadas por quimioterapia em pacientes com câncer em comparação com o grupo controle. Além disso, a combinação de probióticos no tratamento da diarreia induzida por quimioterapia também pode melhorar o efeito terapêutico, com menos eventos adversos.
Nenhuma morte ou efeitos adversos devido à suplementação oral de probióticos foram registrados. No entanto, a eficácia do uso de probióticos orais contra outras reações adversas precisa ser verificada através de mais ensaios clínicos, e as espécies e o número de probióticos devem ser otimizados e padronizados antes das aplicações clínicas.
Notavelmente, os esquemas de tratamento incluindo várias espécies de probióticos exibiram melhores efeitos do que uma única bactéria na terapia adjuvante do câncer.
Além disso, as complicações pós-operatórias devido à infecção foram significativamente reduzidas em pacientes com câncer devido ao uso de probióticos orais.
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.