Neoplasia Intraepitelial Anal (NIA)
Infecção pelo Papilomavírus Humano (HPV)
➧ Classificação da neoplasia intraepitelial anal
➧ Fatores de risco para a neoplasia intraepitelial anal
➧ História natural da neoplasia intraepitelial anal
➧ Sinais e sintomas e diagnóstico da NIA
➧ Populações com risco aumentado para o câncer anal
➧ Abordagem proposta para a triagem da neoplasia intraepitelial anal de alto grau em grupos de alto risco
➧ Momento e frequência do rastreamento da neoplasia intraepitelial anal
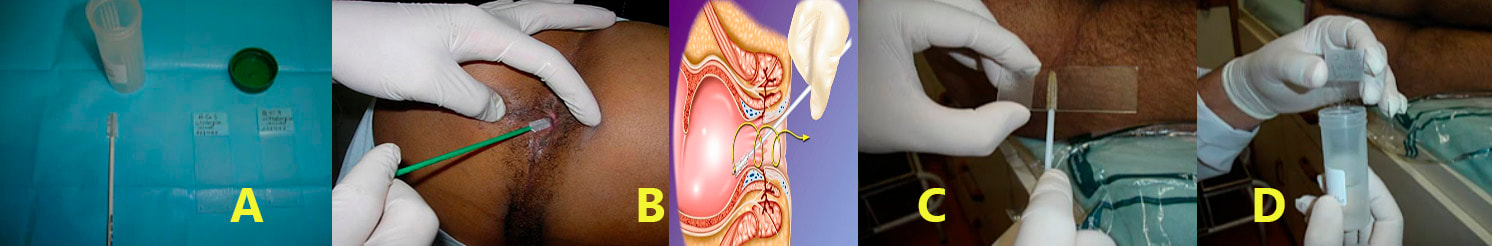
➧ Citologia anal para pesquisa da NIA
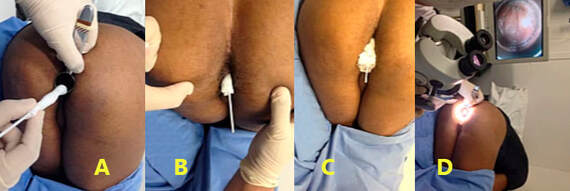
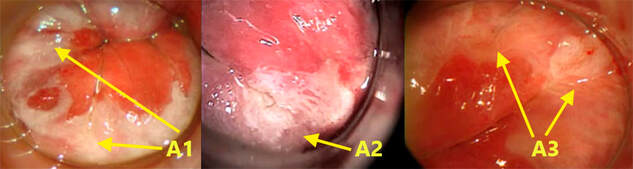
➧ Anuscopia de alta resolução para pesquisa da NIA
➧ Tratamento recomendado para a neoplasia intraepitelial anal e condiloma no canal anal
➧ Modalidades de tratamento para a neoplasia intraepitelial anal e condiloma no canal anal
➧ Neoplasia perianal intraepitelial, doença de Bowen e câncer perianal in situ
➧NIA de alto grau – NIA com displasia moderada, grau II ou com displasia acentuada (severa), grau III.
➧Infecção latente - Ocorre após a infecção pelo HPV, isto é, antes de qualquer evidência clínica da infecção (pode durar oito meses ou mais, mas alguns indivíduos nunca desenvolverão lesões clinicamente aparentes);
➧Infecção com lesões assintomáticas no canal anal - Geralmente lesões planas que podem ser difíceis de identificar na anuscopia convencional; e
➧Lesões sintomáticas condilomatosas típicas no canal anal - Verrugas ou placas isoladas ou confluentes.
Algumas pessoas, particularmente HIV-positivos, podem estar infectados por dois ou mais subtipos de HPV, o que está associado ao aumento do risco de desenvolver a NIA de baixo grau e posteriormente a de alto grau.
➧A infecção pelo HPV no canal anal, número e tipo de HPV(s) presente(s) e comportamento sexual de risco são os fatores de risco que se associam significativamente à presença da NIA.
➧A prevalência da infecção anal pelo HPV em HSH é alta (50 e 60%), mas estável nas idades entre 18 e 50 anos. A estabilidade da prevalência é consistente com as observações de que a infecção pelo HPV é transitória e que os indivíduos permanecem em risco de desenvolver novas infecções pelo HPV se o comportamento de alto risco continuar.
➧Entre as mulheres HIV negativas, as taxas inicialmente altas de HPV nas faixas etárias mais jovens não se sustentam a longo prazo. Entre as mulheres que vivem com HIV, a infecção anal por HPV parece ser pelo menos tão comum quanto a infecção do colo de útero por HPV. A prevalência da infecção anal pelo HPV na mulher com neoplasia intraepitelial no colo do útero, chega a 90%. Apresentam portanto, um risco aumentado de neoplasia intraepitelial anal simultâneo. Toda paciente com HPV ou NIA no colo uterino devem ser examinadas pelo coloproctologista.
➧É importante reforçar que a relação anal receptiva não é o único fator de risco para a aquisição da infecção anal por HPV em mulheres; alguns dados sugerem que a limpeza de frente para trás após a evacuação está associada a taxas mais altas de infecção anal pelo HPV do que dar tapinhas ou limpar na outra direção.
➧Os fatores de risco envolvidos no aumento da prevalência da infecção pelo HPV, neoplasia intraepitelial anal e câncer anal em HSH HIV positivos incluem: comportamento sexual de alto risco, infecção por vários subtipos de HPV e maior frequência do comprometimento do canal anal.
➧A terapia antirretroviral não parece alterar a prevalência da neoplasia intraepitelial anal, e ainda, pode estar associada ao aumento da incidência de progressão da neoplasia intraepitelial anal de alto grau para câncer anal devido ao aumento da expectativa de vida das pessoas infectadas pelo HIV.
Nas mulheres incluem história de câncer do colo do útero, câncer vulvar, neoplasia intraepitelial do colo do útero de alto grau ou neoplasia intraepitelial vulvar, infecção no colo do útero pelo HPV 16 em mulheres HIV negativas com idade superior a 45 anos e imunossupressão iatrogênica (como após o transplante de órgão sólido).
O diagnóstico da neoplasia intraepitelial anal requer, em última análise, exame histopatológico das amostras citológicas e da biópsia anal.
A avaliação de indivíduos assintomáticos com risco aumentado de neoplasia intraepitelial anal começa pela anamnese abrangente, exame físico e proctológico.
• História de doenças provocadas pelo papilomavírus humano (HPV) e outras infecções sexualmente transmissíveis;
• História sexual, incluindo investigação específica sobre relações sexuais receptivas desprotegidas;
• Sorologia para HIV e marcadores de infecção (CD4 e carga viral);
• Sintomas anorretais (dor, coceira, sangramento, corrimento, irritação e tenesmo);
• História de tabagismo; e
• Uso de medicamentos associados à imunossupressão.
O exame físico e o exame proctológico incluem:
• Inspeção visual da pele perianal;
• Exame digital;
• Exame dos linfonodos inguinais e de alta resolução (anuscopia) do canal anal; e
• Se a citologia anal for planejada, ela deve ser realizada antes do exame digital e da anuscopia sem o uso de lubrificante.
• Mulheres HIV negativas com mais de 45 anos com HPV cervical sorotipo 16;
• Homens e mulheres HIV positivos;
• Imunossupressão iatrogênica (por exemplo, receptores de transplante de órgão sólido, corticosteroides orais a longo prazo);
• Mulheres com histórico de displasia ou câncer cervical, vulvar ou vaginal de alto grau; e
• Pessoas com história de verrugas anais (condiloma anal).
• Estes grupos também pode se beneficiar da triagem com a citologia anal: homens HIV positivos que fazem sexo com mulheres, mesmo sem histórico de relações sexuais anal; mulheres HIV positivas; e mulheres HIV negativa com mais de 45 anos de idade que têm HPV cervical 16.
• Outros grupos de risco também podem ser considerados para a triagem da neoplasia intraepitelial anal de alto grau, caso a caso.
B- Com o paciente na posição genupeitoral ou em decúbito lateral esquerdo, a zaragatoa é gentilmente inserida no ânus até ultrapassar o canal anal. Para então ser retirado com pressão lateral em espiral para pegar amostras de toda a circunferência do canal anal. Deste modo são coletadas amostradas celulares do reto inferior, zona de transição escamo-colunar e canal anal.
C- Após a remoção, a amostra pode ser espalhada na lâmina e fixada convencionalmente em etanol ou usar a técnica em citologia líquida. O último método é preferível, quando disponível, pois parece produzir melhores resultados.
D- A sensibilidade da citologia anal para detectar neoplasia intraepitelial anal comprovado por biópsia em HSH HIV positivos e negativos é de 81 e 50%, respectivamente. Semelhante à citologia cervical para a detecção de doença do colo uterino.
• No entanto, os pacientes com NIA de baixo grau podem optar por fazer algum tratamento por vários motivos, incluindo sintomas (queimação, coceira e sangramento) ou sofrimento psicológico. Pacientes com NIA de baixo grau que não são tratados devem ser acompanhados a cada seis meses devido à alta taxa de progressão para NIA de alto grau.
• Resumindo: NIA de baixo grau – seguimento, mas o tratamento é recomendado quando sintomática (geralmente quando comprometem mais de 1/3 da circunferência do canal anal) e/ou na presença de verrugas ou pelo desejo do paciente.
• Para lesões comprometem mais de 1/3 da circunferência do canal anal, o tratamento pode ser a eletrocauterização, mas para evitar estenose, recomenda-se escalonar o tratamento, cauterizando no máximo 1/3 da circunferência do canal anal por sessão. Alternativamente, pode-se usar o imiquimode a 5% creme dentro do canal anal, uma vez que pode resultar na resolução completa das lesões ou na redução do tamanho permitindo assim, o uso da eletrocauterização. Com a vantagem de que o imiquimode pode ser aplicado pelo próprio paciente.
• Resumindo: NIA de alto grau – tratamento combinado (infecção de campo) tópico (imiquimode) com a cirúrgica (excisão e eletrocauterização sob anestesia local e sedação).
• Lesões discretas e pequenas podem ser tratadas com destruição local ou cirúrgica (excisão ou eletrocauterização), enquanto lesões mais extensas podem ser abordadas inicialmente com aplicação do imiquimode a 5% creme, além de observação atenta e contínua, antes de considerar a intervenção cirúrgica.
• Os tratamentos iniciais envolvem medidas mais conservadoras que, novamente, dependem da extensão e tamanho da(s) lesão(s).
• Não há estudos randomizados comparando diferentes modalidades, e a seleção da modalidade é amplamente empírica.
• Aplicado no canal anal pelo médico.
• Opção para lesões pequenas (base <1 cm2).
• A aplicação local do ácido tricloroacético (TCA) a 90% é geralmente bem tolerada, mas pode ocasionalmente ser dolorosa.
• Em estudos, 60 a 80% das lesões evoluíram para epitélio normal ou NIA de baixo grau após uma única sessão de tratamento, e apenas duas lesões (2%) necessitaram de mais de duas sessões de tratamentos.
• Aplicado no canal anal pelo próprio paciente, de acordo com o preconizado (ver acima).
• Pode resultar na resolução patológica da NIA de alto grau anal em homens HIV-positivos que fazem sexo com homens (HSH), quando combinado com a terapia antirretroviral (TARV). Essa abordagem parece ser ainda melhor nos pacientes com doença multifocal disseminada.
• Em uma série relatada, 28 homens com NIA de alto grau foram tratados com imiquimode aplicado no canal anal três vezes por semana durante quatro meses. Dos 28 pacientes que receberam imiquimod, quatro tiveram resolução completa e oito tiveram o NIA de alto grau rebaixado para NIA de baixo grau. Apenas 1 dos 25 pacientes que receberam placebo tiveram resolução do NIA de alto grau. Em um acompanhamento médio de três anos, 61% dos pacientes mantiveram a ausência sustentada da NIA de alto grau.
Existem muitos, incluindo: eritema, ulceração e sangramento com sintomas associados de irritação, queimação e dor, e ocasionais sintomas sistêmicos semelhantes aos da gripe com imiquimode. No entanto, a maioria das terapias locais é muito bem tolerada, com apenas sintomas mínimos experimentados pelo paciente
• A ablação por eletrocautério também é frequentemente usada para tratar a NIA de alto grau, baixo grau e verrugas da região perianal e do canal anal.
• A eficácia foi abordada em uma análise retrospectiva de 330 pacientes com NIA de alto grau que foram seguidos com vigilância pós-tratamento com a anuscopia de alta resolução e biópsia das lesões suspeitas. Em uma média de 12 meses após a ablação, aproximadamente 45% dos participantes desenvolveram recorrência local, enquanto 60% desenvolveram recorrência geral. Nenhum paciente desenvolveu carcinoma espinocelular invasivo (CEC).
• Resultados semelhantes foram observados em uma série de 232 homens tratados com eletrocautério. A probabilidade de controle da doença das lesões iniciais após um único tratamento foi de aproximadamente 80%. A doença recorrente ocorreu em homens HIV negativos e HIV positivos (53 e 6%, respectivamente).
• Pacientes com lesões muito grandes e/ou extensas, a combinação do tratamento cirúrgico (eletrocauterização ou excisão cirúrgica) para as lesões maiores, deixando as menores para o tratamento tópico pelo médico ou pelo próprio paciente, parece ser uma opção viável.
• A alta taxa de recorrência local, mesmo em pacientes inicialmente considerados completamente tratados com um único procedimento, exige vigilância cuidadosa após o tratamento. No entanto, a maioria dessas recorrências pode ser gerenciada com sucesso com tratamento local.
A abordagem cirúrgica pode envolver ressecção local ampliada das lesões com fechamento primário da pele, retalhos de avanço (V-Y, S, C), enxerto cutâneo ou anoplastia.
• É importante ressaltar que o maior problema deste tratamento é a alta morbidade e apresenta taxas de recorrência (ou persistência) das NAI de alto grau entre 10 e 25%, mesmo quando se utiliza minucioso mapeamento pré-operatório. Assim, as terapias ablativas locais como a eletrocauterização constituem alternativas com menor morbidade que vêm ganhando muitos adeptos como alternativa às excisões ampliadas.
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.