Colonoscopia no Tratamento das Doenças Colorretais |
|
A colonoscopia é método eficaz no tratamento das doenças do cólon e reto, sendo segura e com baixo índice de complicações.
Biópsia (coleta de material para exame em laboratório)
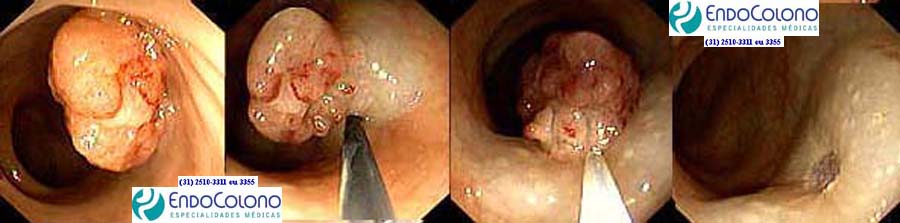
Estudo dos pólipos pela colonoscopia
Tratamento dos Pólipos pela Colonoscopia
Técnicas usadas para retirar os pólipos por colonoscopia
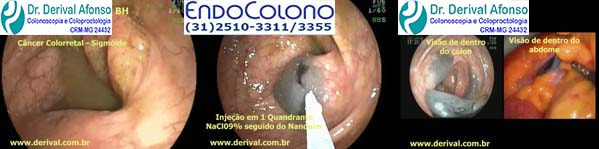
Tatuagem do cólon com tinta nanquim
Complicações pós-polipectomia: SANGRAMENTO E PERFURAÇÃO
Tratamento da hemorragia digestiva baixa (sangramento intestinal)
Preparo para a colonoscopia
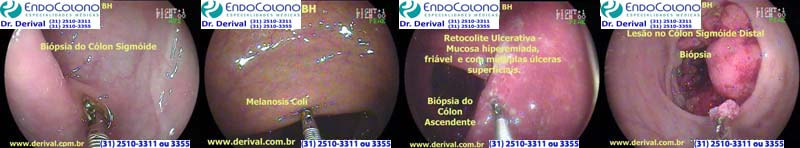
Biópsia é um termo usado para descrever a remoção de uma amostra de tecido para enviar ao laboratório de anatomia patológica para análise.
Para a biópsia na colonoscopia, uma pinça de biópsia é introduzida pelo canal de trabalho do aparelho até a ponte. A concha da pinça é aberta e fechada sobre o tecido ou lesão, seguido de uma tração forte para arrancar um pequeno fragmento.
|
A biópsia pela colonoscopia é uma forma importante de diagnosticar doenças intestinais (ileal e colorretal). O médico coleta pequenas amostras de tecido para ser enviadas para o laboratório e serem examinadas por um médico patologista sob um microscópio. O patologista é um médico especialista treinado para examinar a amostra de tecido em busca de sinais e extensão da doença sob um microscópio.
A biópsia durante a colonoscopia é segura, indolor e é considerada um procedimento de muito baixo risco. |
Uma grande variedade de condições não neoplásicas pode ser encontrada na colonoscopia, abrangendo etiologias idiopáticas, infecciosas, vasculares e autoimunes, cujo diagnóstico, na maioria das vezes, dependerá da biópsia. Na maioria dos cenários clínicos e endoscópicos a biópsia endoscópica pode fornecer o diagnóstico histológico, embora a interpretação da biópsia possa ser desafiadora.
A doença colorretal não neoplásica constitui uma parte considerável da carga de trabalho diária do colonoscopista e do patologista. Os padrões macroscópicos das doenças da mucosa ileal e colorretal são limitados e quase sempre inespecíficos. Neste cenário, a biópsia endoscópica é uma importante ferramenta diagnóstica. No entanto, este espectro endoscópico limitado de padrões pode ser refletido nos achados microscópicos, que muitas vezes demonstram sobreposição significativa entre os vários subtipos e etiologias de colite. Isso reforça a necessidade do colonoscopista descrever detalhadamente o padrão das lesões e alterações da mucosa, em vez de apenas sugerir uma etiologia subjacente.
O padrão predominante da lesão observado na biópsia, juntamente com a impressão endoscópica e a história clínica, pode permitir que o patologista sugira uma variedade de etiologias com diagnóstico diferencial ou, em alguns casos, sugira um diagnóstico específico.
Identificar a etiologia de uma anormalidade em amostras de biópsia colorretal pode ser difícil. Muitas vezes, há sobreposição significativa entre várias condições que podem produzir alterações morfológicas semelhantes. No entanto, o manejo e as implicações clínicas podem ser muito diferentes. A avaliação histológica pode desempenhar um papel crucial no estabelecimento do diagnóstico. Mais importante ainda, uma abordagem multidisciplinar, integrando as características clínicas, endoscópicas e patológicas, geralmente ajudará a otimizar a precisão do diagnóstico e a qualidade do tratamento.
A doença colorretal não neoplásica constitui uma parte considerável da carga de trabalho diária do colonoscopista e do patologista. Os padrões macroscópicos das doenças da mucosa ileal e colorretal são limitados e quase sempre inespecíficos. Neste cenário, a biópsia endoscópica é uma importante ferramenta diagnóstica. No entanto, este espectro endoscópico limitado de padrões pode ser refletido nos achados microscópicos, que muitas vezes demonstram sobreposição significativa entre os vários subtipos e etiologias de colite. Isso reforça a necessidade do colonoscopista descrever detalhadamente o padrão das lesões e alterações da mucosa, em vez de apenas sugerir uma etiologia subjacente.
O padrão predominante da lesão observado na biópsia, juntamente com a impressão endoscópica e a história clínica, pode permitir que o patologista sugira uma variedade de etiologias com diagnóstico diferencial ou, em alguns casos, sugira um diagnóstico específico.
Identificar a etiologia de uma anormalidade em amostras de biópsia colorretal pode ser difícil. Muitas vezes, há sobreposição significativa entre várias condições que podem produzir alterações morfológicas semelhantes. No entanto, o manejo e as implicações clínicas podem ser muito diferentes. A avaliação histológica pode desempenhar um papel crucial no estabelecimento do diagnóstico. Mais importante ainda, uma abordagem multidisciplinar, integrando as características clínicas, endoscópicas e patológicas, geralmente ajudará a otimizar a precisão do diagnóstico e a qualidade do tratamento.
Uma vez identificado o pólipo, é necessário estudá-lo para definir se é possível a remoção por colonoscopia e qual é a melhor técnica a ser empregada. Avaliar se o aparelho está bem posicionado e de fácil manuseio para o tratamento imediato das complicações. É importante ter em mente os acessórios disponíveis para o procedimento proposto assim como para o tratamento das complicações.
Cromoscopia
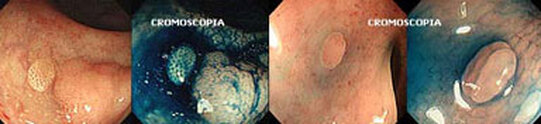
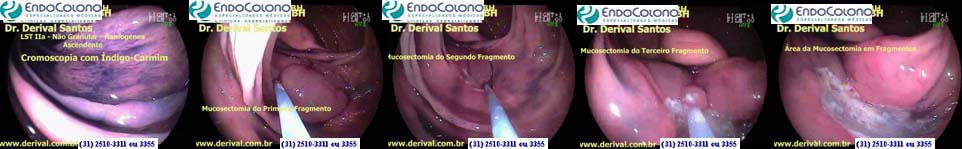
Cromoscopia ou cromoendoscopia do cólon com índigo carmim a 0,2 a 0,5%. Consiste em aplicar um corante pelo canal do aparelho ou por cateter que em contato com a mucosa do cólon melhora a avaliação da superfície permitindo obter informações detalhadas da lesão, assim como do seu tamanho, limites e localização.
Deve ser aplicado com cuidado para não machucar a lesão e causar sangramento, o que dificultaria a avaliação. O corante recomendado no cólon e reto é o índigo carmim a 0,2 a 0,5%. A cromoscopia é usada para caracteriza melhor, delinear e realçar as lesões encontradas durante a colonoscopia. É importante limpar a superfície de lesões suspeitas retirando muco ou resíduos com água e às vezes com mucolíticos (N-acetilcisteína a 10%).
A cromoscopia pode ser utilizada de modo rotineiro, principalmente no ceco e cólon direito, para aumentar a chance de encontrar pólipos e lesões. Portanto, o mérito da cromoscopia é a determinação dos limites exatos da lesão, a visualização de partes ocultas e a demonstração de áreas deprimidas ou elevadas por meio do acúmulo e da distribuição do corante.
A videocolonoscopia convencional, sem magnificação de imagem, mesmo quando realizada por examinador experiente e com emprego de técnica de cromoscopia apresenta capacidade limitada de diferenciação de pólipos colorretais neoplásicos e não-neoplásicos. Quanto à diferenciação de pólipos colorretais benignos e malignos, não ocorreu nenhum caso de "subdiagnóstico. Algumas lesões benignas foram "superdiagnosticados" como malignas, o que, no entanto, não trouxe nenhum prejuízo uma vez que todos foram biopsiados.
Ao contrário da videocolonoscopia com magnificação de imagem, a videocolonoscopia convencional (sem magnificação de imagem) com cromoscopia é um exame diagnóstico de segurança limitada para determinação do diagnóstico histológico de lesões colorretais.
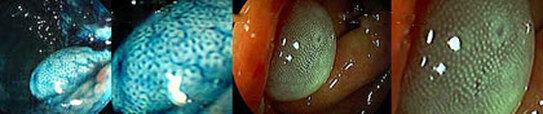
Magnificação de imagem pela colonoscopia
É a capacidade da colonoscopia em ampliar as imagens em tempo real (magnificação) permitindo a visualização de detalhes que não podem ser vistos com a colonoscopia padrão. As imagens podem ser aprimoradas ainda mais pelo uso de corantes (cromoscopia convencional) ou pelo próprio aparelho eletronicamente (cromoscopia eletrônica).
Os colonoscópios de magnificação possuem um mecanismo de foco ajustável que permite imagens endoscópicas padrão e a capacidade de ampliar a imagem de 1,5X a 200X.
O consenso entre observadores da análise da superfície das lesões é alto, mas não deve ser usada para decidir quais lesões colorretais devem ser retiradas ou não, uma vez que não se consegue diferenciar com precisão e segurança necessária as lesões neoplásicas (adenoma e serrilhado) das não-neoplásicas. Além disso, é baixa a capacidade em diferenciar as lesões neoplásicas não invasivas (câncer precoce) das neoplásicas invasivas (câncer avançado).
Os especialistas concordam que a colonoscopia com magnificação é útil, mas não substitui a avaliação histológica (biópsia) das lesões removidas.
Indicações da cromoscopia na colonoscopia
|
A observação endoscópica com cromoscopia pode ser utilizada como método auxiliar em várias situações:
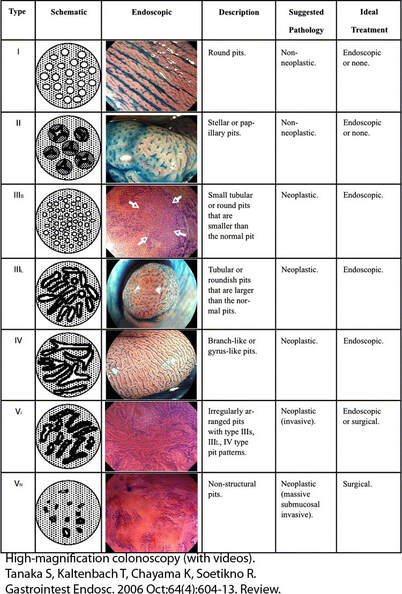
- Estudo das lesões encontradas na colonoscopia convencional; - Determinação com segurança das margens das lesões colorretais; - Pesquisar lesão residual após as retiradas endoscópicas. - No seguimento dos pacientes com doença inflamatória intestinal (doença de Crohn e retocolite ulcerativa) para avaliar o grau de atividade e prevenção do câncer colorretal. Magnificação de imagem, permite a avaliação dos padrões de criptas da mucosa intestinal (pits), sendo a classificação de Kudo a mais utilizada.
A classificação de Kudo subdivide o padrão de criptas em várias categorias (I, II, IIIL, IIIS, IV, Vi (irregular) e Vn (não-estrutural).
|
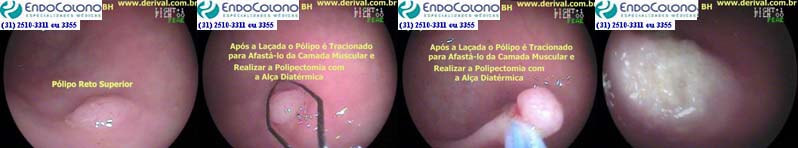
Todos os pólipos localizados no cólon e reto devem ser retirados pela colonoscopia ou cirurgia. A maioria dos pólipos é retirada pela colonoscopia com baixas taxas de complicações. Recomenda-se que os pólipos menores de 10 mm sejam retirados na introdução do colonoscópio, assim que identificados, porque existe o risco de serem perdidos na retirada do aparelho.
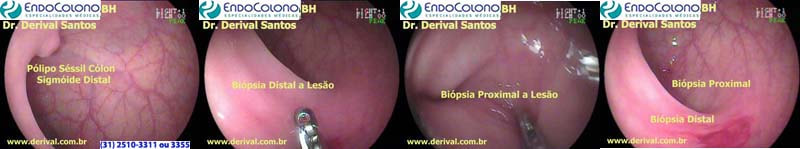
A retirada de lesões maiores são trabalhosas e demandam mais tempo quando a injeção constante de ar para manter a luz aberta e retirar o pólipo pode dificultar o término do exame do exame. Para minimizar o risco de perda da lesão e a distensão exagerada do intestino, o local do pólipo pode ser marcado realizando duas biópsias, uma proximal e outra distal a lesão, facilitando a sua identificação e consequente a sua remoção na retirada do colonoscópio.
Adenomas de baixo risco e adenomas avançados de alto risco são perdidos pela colonoscopia com mais frequência do que se acreditava anteriormente.
As perdas chegam a 27% para pólipos serrilhados, 26% para adenomas de baixo risco e 9% para adenomas avançados de alto risco (adenoma tubular ≥ 10 mm; adenoma viloso e displasia de alto grau). As taxas de perda são maiores para adenomas avançados proximais (cólon direito), pólipos serrilhados, adenomas planos e em pacientes com alto risco de câncer colorretal.
As taxas de perda podem ser reduzidas pela preparação adequada do intestino, exame cuidadoso dos ângulos e das pregas intestinais, distensão adequada da luz intestinal e tempo gasto para retirar o aparelho maior que 6 minutos. Atenção a pacientes com múltiplos pólipos e naqueles com histórico de pólipos, porque esses pacientes correm um alto risco de pólipos perdidos na colonoscopia.
Pólipo séssil com até 3 mm de tamanho
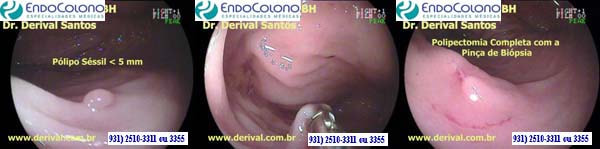
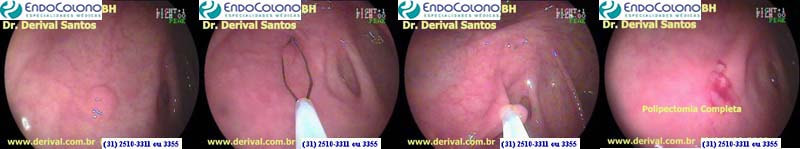
A polipectomia com pinça fria é adequada para lesões com tamanho igual ou inferior a 3 mm. Idealmente, a lesão deve ser completamente envolvida pela pinça, sem tecido sobrando, para que toda a lesão seja removida em uma única mordida. Se ficar tecido residual, mordidas adicionais podem ser realizadas.
A vantagem desta técnica é que uma amostra é sempre recuperada para exame em laboratório. Outra vantagem consiste na não utilização do cautério com risco de sangramento e perfuração desprezíveis.
A desvantagem do uso da pinça é a dúvida sobre a remoção completa do pólipo. Em um estudo, 29% dos pacientes ainda apresentavam tecido neoplásico residual 3 semanas após o tratamento.
Pólipo séssil entre 4 e 9 mm de tamanho
Polipectomia com alça a frio, sem usar o cautério
A alça de polipectomia a frio é a técnica preferida para os pólipos de até 9 mm de tamanho. É rápida, eficaz e segura. Displasia de alto grau é encontrada em cerca de 7% dos pólipos de 6 a 9 mm, mas o câncer ocorre em menos de 1%. O risco de câncer em lesões menores do que 10 mm parece estar diminuindo constantemente nas publicações ao longo do tempo, provavelmente refletindo o aumento da resolução e detecção proporcionada pelas colonoscopias de prevenção.
Para lesões maiores que 9 mm, pode ser difícil cortar o tecido com a alça sem cauterizar aumentando o risco de sangramento.
Uma alça de polipectomia pequena, mais rígida e fina e com abertura de menos de 12 mm é a ideal. A lesão deve ser colocada na posição das 5 horas, abre-se a alça e circunda o pólipo sem aspiração de ar. Então, a alça captura lentamente o pólipo com pelo menos 1 a 2 mm de tecido normal circundante. O pólipo é cortado, mas não deve ser levantado até que o fechamento da alça seja completo. O pólipo é aspirado através do canal de trabalho para um recipiente.
Taxas zero de perfuração e de menos de 2% de sangramento imediato, sem diferença quando comparado com os retirados com alça com cautério. Este sangramento é discreto e facilmente controlado com técnicas de hemostasia por colonoscopia.
Após a retirada do pólipo com alça de polipectomia a frio, um cordão de tecido branco protuberante é frequentemente visto na área de ressecção. Este tecido é mais comumente visto após a remoção de pólipos maiores ou quando uma margem maior de tecido ao redor de um pólipo pequeno é laçada. Dois estudos relatam que as biópsias deste cordão demonstram apenas a submucosa ou muscular da mucosa e raramente pólipo residual. Assim, quando o cordão está presente, pode ser deixado sem tratamento adicional ou amostragem.
Polipectomia com alça usando o cautério
Segue-se o mesmo procedimento descrito no uso da alça a frio, mas no momento de cortar o pólipo, utiliza-se a corrente elétrica produzida pelo cautério.
O cautério pode lesar a parede intestinal em graus variáveis e levar à síndrome pós-polipectomia e mesmo a perfuração. Portanto, deve ser usado com cautela em comparação com a alça a frio. Para minimizar este risco deve-se evitar apreender excesso de tecido normal e o pólipo laçado deve ser afastado da parede do cólon antes da aplicação da corrente elétrica. Atualmente, não há consenso sobre o tipo ideal de corrente que deve ser usado, mas geralmente utiliza-se corrente mista (blend)
Pólipo séssil maior ou igual a 10 mm e LST (lesão de crescimento lateral)
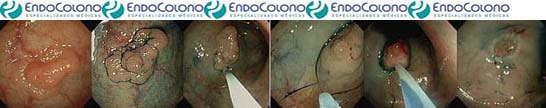
Ressecção Endoscópica da Mucosa - Mucosectomia
A ressecção endoscópica da mucosa - mucosectomia - é para lesões maiores que 15 mm e recomendado para 10 a 15 mm, mas alguns fazem a frio. Para lesões de 10 a 20 mm consegue-se, na maioria, a retirada em bloco e nas maiores de 20 mm recomenda-se o fatiamento para reduzir o risco de perfuração.
Consiste na injeção de soro fisiológico (NaCl 0,9%) com ou sem adrenalina (1:10.000 a 1:20.000) ou outras soluções abaixo da lesão para levantá-la, criando um plano protetor para colocar a alça de polipectomia e usar com certa segurança a corrente do eletrocautério (mista tipo blend 1). A lógica é facilitar a retirada endoscópica e potencialmente diminuir o risco de perfuração.
O pólipo deve ser orientado na posição das seis horas, que corresponde ao canal de trabalho do endoscópio. O pólipo é laçado e aplicado cauterização para ressecar o tecido.
Geralmente a solução é injetada no centro da lesão ou na borda proximal para que seja exposta. Antes de retirá-lo, é necessário definir as margens da lesão e na dúvida usa-se a cromoendoscopia convencional ou eletrônica com ou sem magnificação.
A falha no levantamento homogêneo da lesão com a injeção da solução suscita preocupação por malignidade, desde que o pólipo não tenha sido submetido a uma tentativa anterior de ressecção (o que poderia resultar em tecido cicatricial fixando a lesão na submucosa)
A injeção submucosa pode ter desvantagens.
--A solução salina pode ser absorvida rapidamente e novas injeções pode dificultar laçar a lesão.
--O líquido injetado pode aumentar a tensão do tecido submucoso e dificultar a captura da alça (isto é, a alça desliza para fora do plano submucoso durante o fechamento).
--O líquido injetado pode se dissipar ao longo do plano submucoso, elevando o pólipo e a mucosa normal adjacente. Isso pode fazer com que o pólipo fique achatado ou deprimido em relação ao tecido circundante.
--A injeção pode deslocar a lesão para um local menos acessível, como atrás de uma dobra, ou contrair a luz, dificultando o acesso.
--A solução salina pode ser absorvida rapidamente e novas injeções pode dificultar laçar a lesão.
--O líquido injetado pode aumentar a tensão do tecido submucoso e dificultar a captura da alça (isto é, a alça desliza para fora do plano submucoso durante o fechamento).
--O líquido injetado pode se dissipar ao longo do plano submucoso, elevando o pólipo e a mucosa normal adjacente. Isso pode fazer com que o pólipo fique achatado ou deprimido em relação ao tecido circundante.
--A injeção pode deslocar a lesão para um local menos acessível, como atrás de uma dobra, ou contrair a luz, dificultando o acesso.
Após a ressecção, o local da polipectomia deve ter uma superfície "limpa". A ressecção completa do pólipo em uma única sessão é fundamental, pois as cicatrizes dificultam uma segunda tentativa de ressecção.
A mucosectomia ideal é a que retira toda a lesão em um fragmento, ou seja, em bloco. As lesões com mais de de 20 mm essa ressecção em bloco pode ser difícil, além de aumentar o risco de complicações, principalmente a perfuração. Para essas lesões maiores de 20 mm, recomenda-se a retirada em fragmentos (mucosectomia a piecemeal).
Pólipos pediculados com pedículos com menos de 10 mm de diâmetro
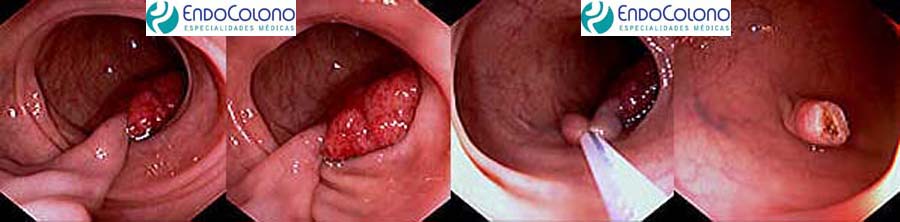
São retirados com a alça de polipectomia usando o eletrocautério pela técnica simples
A técnica padronizada para remover esses pólipos pediculados consiste em abrir alça de polipectomia além da cabeça do pólipo recuando-a lentamente até laçar o pólipo. O pedículo deve ser laçado próximo à sua cabeça, com cuidado para garantir margem de segurança no caso de existir câncer associado e, ao mesmo tempo, um coto do pedículo residual visível que possa ser laçado no caso de sangramento.
Assim que a alça for fechada aplica-se a corrente mista (cauterização blend 1) para evitar o corte a frio e assim, reduzir a frequência de sangramento.
O coto residual do pedículo deve ser revisado alguns minutos após a polipectomia para assegurar a ausência de sangramento. O pólipo é recuperado e enviado para análise. Todo o processo é indolor.
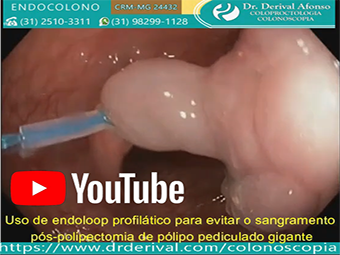
As taxas de sangramento aumentam quando o pedículo é > 5 mm. No entanto, o tamanho para a aplicação de medidas profilática para evitar sangramentos não é conhecido. As diretrizes recomendam que, para um pólipo pediculado com uma cabeça ≥ 20 mm ou um pedículo ≥ 10 mm de diâmetro, usar medidas mecânicas para hemostasia e/ou usar uma injeção de adrenalina diluída
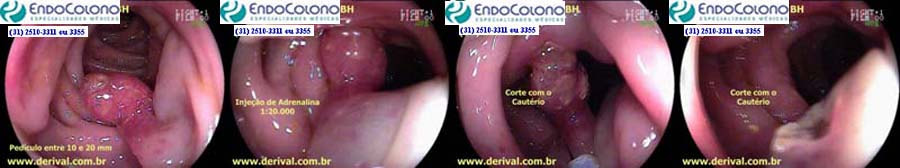
Pólipos pediculados com pedículos entre 10 e 20 mm de diâmetro
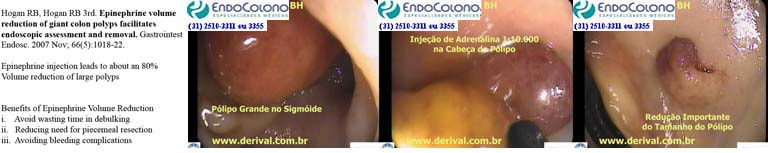
Injeção de adrenalina na prevenção de sangramento para pólipos com pedículos entre 10 e 20 mm de diâmetro.
As diretrizes recomendam, como medida profilática de sangramento pós-polipectomia, a injeção de 1 a 2 ml de solução de adrenalina diluída (1:10.000) na submucosa da base do pedículo para um pólipo pediculado com uma cabeça ≥20 mm e/ou um pedículo entre 10 e 20 mm de diâmetro.
A técnica padronizada para remover esses pólipos pediculados consiste em abrir alça de polipectomia além da cabeça do pólipo recuando-a lentamente até laçar o pólipo. O pedículo deve ser laçado próximo à sua cabeça, com cuidado para garantir margem de segurança no caso de existir câncer associado e, ao mesmo tempo, um coto do pedículo residual visível que possa ser laçado no caso de sangramento.
Recomenda-se, para estes pólipos pediculados maiores, manter o pedículo estrangulado por cerca de 4 a 5 minutos com o intuito de reduzir o fluxo sanguíneo e iniciar a cascata de coagulação. A técnica para cauterizar e cortar o pedículo do pólipo pediculado consiste em aplicar uma coagulação rápida (1 a 2 s) de corrente mista blend 3 (12% coagulação e 88% corte) seguido pelo corte com corrente mista blend 1 (80% corte e 20% coagulação) e durante este corte é recomendado movimentar continuamente o pólipo para evitar que a sua cabeça fique em contato constante com uma área da parede do cólon e possa, por transferência de corrente, causar lesões.
Com isto, passando-se do Blend 1 (Mínimo) para o Blend 3 (Máximo), por exemplo, acrescenta-se progressivamente maior índice de coagulação no Corte. A função Blend 3 terá assim um corte com nível de coagulação maior que as anteriores.
O coto residual do pedículo deve ser revisado alguns minutos após a polipectomia para assegurar a ausência de sangramento. O pólipo é recuperado e enviado para análise. Todo o processo é indolor.
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
As diretrizes recomendam, como medida profilática de sangramento pós-polipectomia, a injeção de 1 a 2 ml de solução de adrenalina diluída (1:10.000) na submucosa da base do pedículo para um pólipo pediculado com uma cabeça ≥20 mm e/ou um pedículo entre 10 e 20 mm de diâmetro.
A técnica padronizada para remover esses pólipos pediculados consiste em abrir alça de polipectomia além da cabeça do pólipo recuando-a lentamente até laçar o pólipo. O pedículo deve ser laçado próximo à sua cabeça, com cuidado para garantir margem de segurança no caso de existir câncer associado e, ao mesmo tempo, um coto do pedículo residual visível que possa ser laçado no caso de sangramento.
Recomenda-se, para estes pólipos pediculados maiores, manter o pedículo estrangulado por cerca de 4 a 5 minutos com o intuito de reduzir o fluxo sanguíneo e iniciar a cascata de coagulação. A técnica para cauterizar e cortar o pedículo do pólipo pediculado consiste em aplicar uma coagulação rápida (1 a 2 s) de corrente mista blend 3 (12% coagulação e 88% corte) seguido pelo corte com corrente mista blend 1 (80% corte e 20% coagulação) e durante este corte é recomendado movimentar continuamente o pólipo para evitar que a sua cabeça fique em contato constante com uma área da parede do cólon e possa, por transferência de corrente, causar lesões.
Com isto, passando-se do Blend 1 (Mínimo) para o Blend 3 (Máximo), por exemplo, acrescenta-se progressivamente maior índice de coagulação no Corte. A função Blend 3 terá assim um corte com nível de coagulação maior que as anteriores.
O coto residual do pedículo deve ser revisado alguns minutos após a polipectomia para assegurar a ausência de sangramento. O pólipo é recuperado e enviado para análise. Todo o processo é indolor.
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
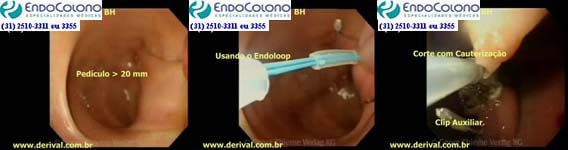
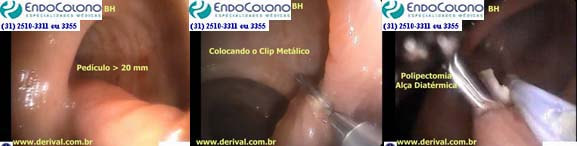
Pólipos pediculados com pedículos com mais de 20 mm de diâmetro
Estudos mostraram que pólipos com pedículos com mais de 20 mm de diâmetro têm um risco significativamente maior de sangramento imediato pós-polipectomia. Os resultados demonstraram que o tratamento profilático contra o sangramento pós-polipectomia em pacientes com pólipos com mais de 20 mm com hemostasia mecânica é mais eficaz do que a injeção de adrenalina para a prevenção de sangramento pós-polipectomia geral (2,2% vs. 6,3%) e sangramento pós-polipectomia imediato (1,1% vs. 4,5%).
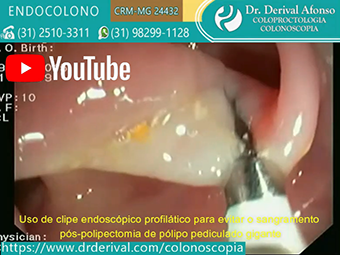
A eficácia dos dispositivos mecânicos (endoloop ou clipe endoscópico) para prevenir o sangramento pós-polipectomia por meio de sua fixação no pedículo do pólipo ou fechamento do defeito da mucosa foi bem estabelecida. No entanto, estudos randomizados controlados não conseguiram demonstrar a eficácia dos clipes na prevenção do sangramento pós-polipectomia tardio. Ambos são usados isoladamente ou em combinação com injeção de adrenalina na base do pedículo.
A eficácia dos dispositivos mecânicos (endoloop ou clipe endoscópico) para prevenir o sangramento pós-polipectomia por meio de sua fixação no pedículo do pólipo ou fechamento do defeito da mucosa foi bem estabelecida. No entanto, estudos randomizados controlados não conseguiram demonstrar a eficácia dos clipes na prevenção do sangramento pós-polipectomia tardio. Ambos são usados isoladamente ou em combinação com injeção de adrenalina na base do pedículo.
O endoloop é colocado no pedículo do pólipo da mesma maneira que uma alça de polipectomia, mas depois de apertado é solto ao redor do pedículo. No entanto, existem problemas com os endoloops, como, por ser flexíveis, ter dificuldade em laçar o pólipo ou estrangular adequadamente, quando o sangramento imediato pode ocorrer. Sendo assim, o corte do pólipo com o eletrocautério deve ser realizado alguns minutos após o endolop ser apertado, tempo necessário para que o endoscopista perceba a alteração da cor da cabeça do pólipo de vermelho vivo para violáceo, demostrando diminuição significativa do fluxo de sangue.
|
|
|
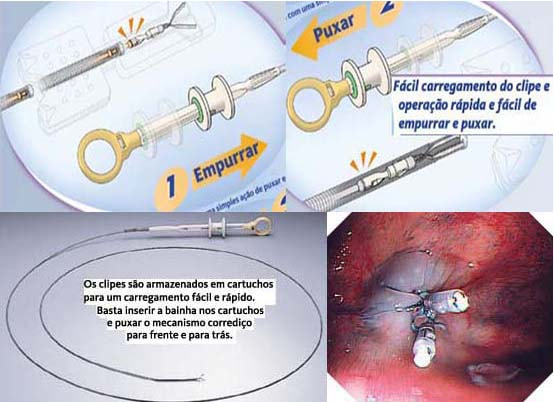
Um ou mais clipes endoscópicos são colocados na base do pedículo imediatamente antes da polipectomia. A principal vantagem dessa abordagem é que os clipes endoscópicos geralmente são fáceis de colocar. As desvantagens incluem a frequente necessidade de usar vários clipes nos pedículos muito grandes e, de fato, pode ser inviável quando os clipes endoscópicos podem não ter tamanho suficiente para pegar todo o pedículo, mesmo quando vários clipes são aplicados. Outra desvantagem é o processo inflamatório que pode surgir em torno dos clipes que não caem dificultando a diferenciação com pólipo residual nas colonoscopias de controle.
|
|
|
Pólipos pediculados com a cabeça grande, maior que 25 mm
Quando identificado na introdução do colonoscópio, recomenda-se injetar em sua cabeça, solução com adrenalina variando 1:10.000 a 1:20.000. Reduz o fluxo de sangue e consequentemente o seu tamanho.
Na retirada do colonoscópio, quando provavelmente o pólipo já tenha ficado menor, realiza-se a polipectomia com ou sem a medidas profiláticas de sangramento usando o endoloop (laço oval de nylon destacável) ou clip endoscópico metálico, isoladamente ou em combinação com injeção de adrenalina na base do pedículo. Dependerá do julgamento do médico examinador.
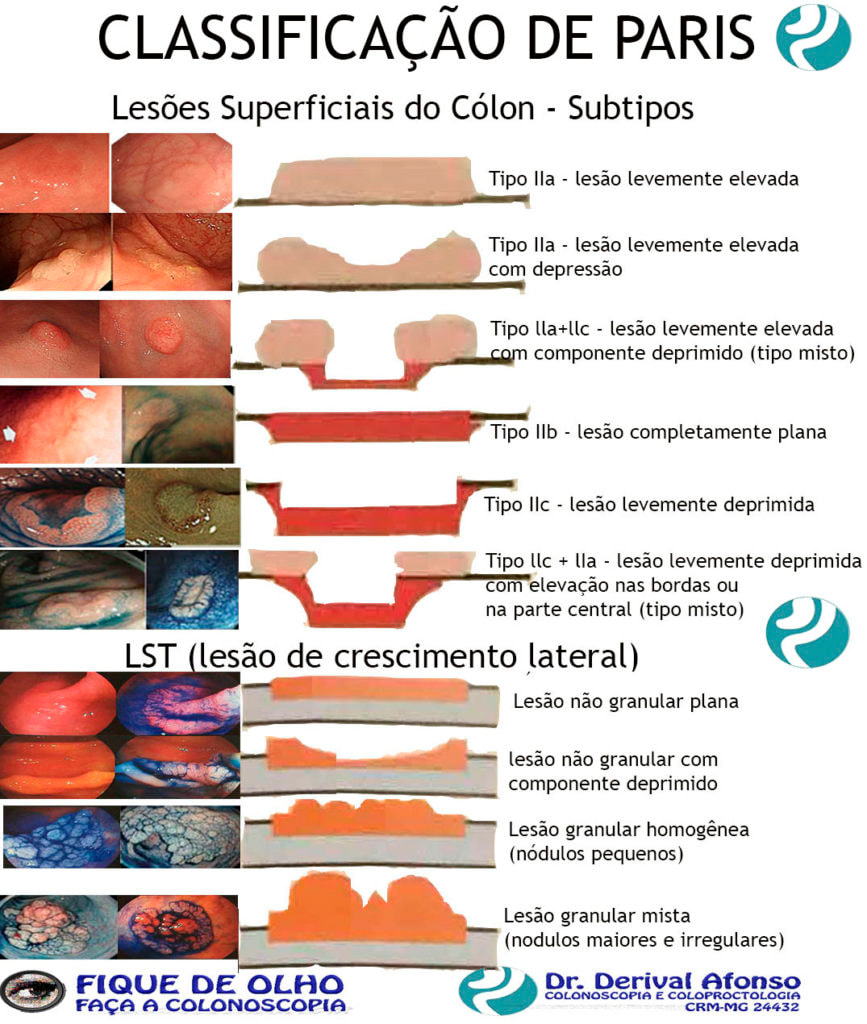
Lesões Superficiais do Cólon
As lesões superficiais do cólon são as lesões nas quais o comprimento lateral e maior que a altura da lesão. Classificadas de acordo a sua forma em: superficialmente elevadas, deprimidas e de crescimento lateral.
As lesões superficiais do cólon são as lesões nas quais o comprimento lateral e maior que a altura da lesão. Classificadas de acordo a sua forma em: superficialmente elevadas, deprimidas e de crescimento lateral.
O risco de evoluir para câncer é maior quando comparado a lesões elevadas (pediculada e séssil), mas o diagnóstico é mais difícil. Portanto, a identificação dessas lesões tem importância fundamental para a prevenção do câncer colorretal.
O risco de evoluir para câncer é maior quando comparado a lesões elevadas (pediculada e séssil), mas o diagnóstico é mais difícil. Portanto, a identificação dessas lesões tem importância fundamental para a prevenção do câncer colorretal.
|
Classificação de Paris
ᴥ» Tipo IIa - lesão levemente elevada; ᴥ» Tipo IIb - lesão completamente plana; ᴥ» Tipo IIc - lesão levemente deprimida; ᴥ» Tipo III - lesão ulcerada; ᴥ» Tipo lla+llc - lesão levemente elevada com componente deprimido (tipo misto); ᴥ» Tipo llc + lIa - lesão levemente deprimida com elevação nas bordas ou na parte central (tipo misto). Lesões planas elevadas (IIa) e lesões sésseis (Is) podem ser confundidas. A diferenciação se faz medindo a altura da lesão com a pinça de biópsia fechada, quando for mais elevada que pinça, isto é, maior que 2,5 mm é considerada séssil.
|
ᴥ» LST (lesão de crescimento lateral) - Considerada quando a lesão superficialmente elevada é maior que 10 mm. São classificadas em:
♦Lesão não granular plana;
♦Lesão não granular com componente deprimido.
♦Lesão granular homogênea (nódulos pequenos);
♦Lesão granular mista (nodulações maiores e irregulares);
♦Lesão não granular plana;
♦Lesão não granular com componente deprimido.
♦Lesão granular homogênea (nódulos pequenos);
♦Lesão granular mista (nodulações maiores e irregulares);
Técnicas endoscópicas recomendadas para a retida (ressecção) das lesões superficiais do cólon
Tipo IIa menores que 2 cm. Tipo IIb menores que 1 cm
É usado a mesma técnica recomendada para os pólipos sésseis (alça de polipectomia a ᴥ» ᴥ» frio ou com eletrocautério ou a mucosectomia).
Tipo IIc, IIc+IIa e IIa+IIc menores que 1 cm
É usado sempre a técnica da mucosectomia em bloco (único fragmento). Exceto quando faltar a elevação da lesão ou a elevação da lesão for disforme com a injeção na submucosa (abaixo da lesão). Isso sugere câncer invasivo e impede o tratamento endoscópico. Nesse caso, faz-se a tatuagem alguns centímetros distais com tinta nanquim.
Tipo III - São lesões escavadas, isto é, do tipo ulcerado.
Apresentam uma alta incidência de câncer invasivo, independentemente do tamanho. Exceto quando faltar a elevação da lesão ou a elevação da lesão for disforme com a injeção na submucosa (abaixo da lesão). Isso sugere câncer invasivo e impede o tratamento endoscópico. Nesse caso, faz-se a tatuagem alguns centímetros distais com tinta nanquim.
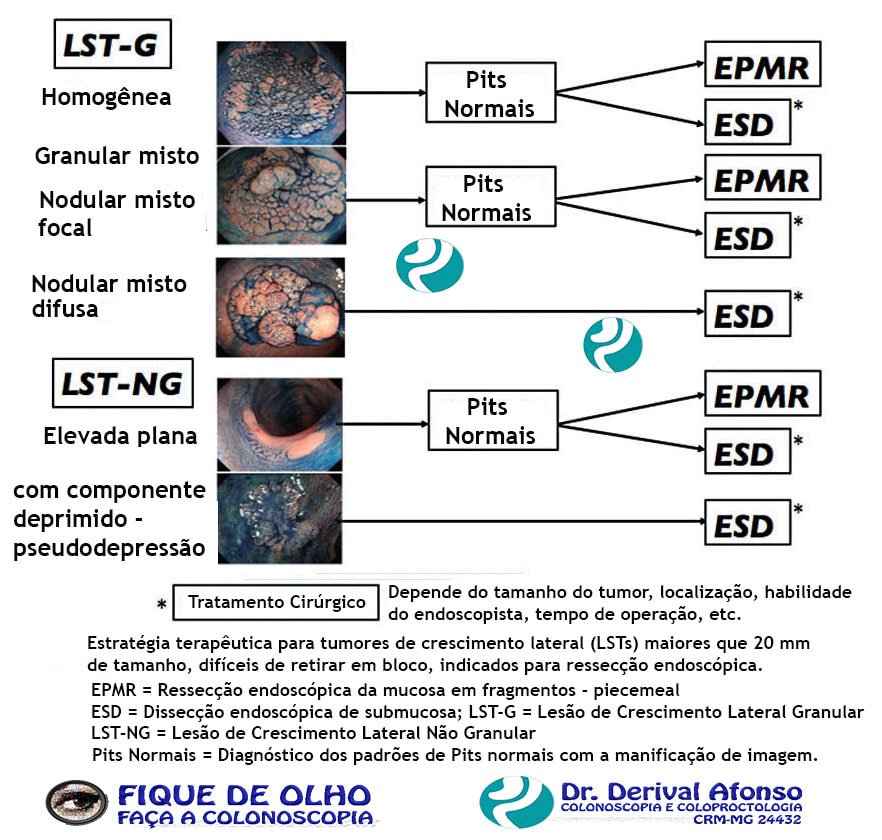
LST (lesão de crescimento lateral)
A técnica de remoção, por colonoscopia ou por cirurgia, depende do tipo da lesão, da disponibilidade do serviço e da experiência da equipe.
Lesão entre 10 e 20 mm de tamanho
Ressecção endoscópica da mucosa (mucosectomia) em bloco único (EMR). Apenas quando o estudo da lesão pela cromoscopia com ou sem magnificação conseguir descartar áreas de câncer e a mesma se elevar por completo e de forma homogênea, após a injeção de solução na submucosa, sugerindo ausência de câncer invasivo.
Lesão maior que 20 mm de tamanho
|
Ressecção endoscópica da mucosa em fragmentos - piecemeal - (EPMR) ou dissecção endoscópica de submucosa (ESD). O tamanho e forma da lesão, a experiência do endoscopista e o material disponível definem qual tipo de técnica usar.
Embora a ESD tenha um tempo de procedimento mais longo e uma maior taxa de perfuração, o seu uso fornece, frequentemente, uma ressecção em bloco. No entanto, a técnica EPMR é considerada uma opção válida para ressecção de grandes lesões, uma vez que a ESD é pouco disponível. Na EPMR a presença de lesão residual (retirada incompleta) é de 16 % (geralmente uniforme e diminuto), enquanto a recorrência tardia é de 4%. Em ambos os casos se consegue o tratamento endoscópico em 93% dos casos.
|
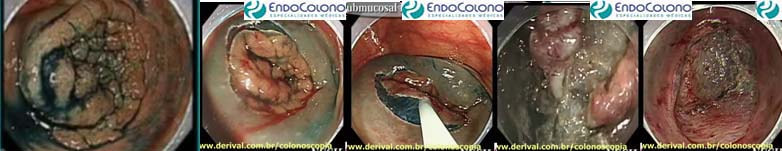
Dissecção endoscópica de submucosa (ESD)
Permite a retirada de grandes lesões em bloco, através da criação de um plano na submucosa (camada entre a lesão de mucosa e a camada muscular). Esse plano é criado com a injeção de solução salina fisiológica (NaCl 0,9%) seguido da injeção da solução de absorção lenta como o HPMC (hidroxipropilmetilcelulosa) ou manitol, misturado com uma pequena quantidade de índigo carmim e adrenalina.
O corante índigo carmim facilita a visualização da camada submucosa e a adrenalina reduz o sangramento durante o procedimento. Um “cap” transparente é acoplado na ponta do endoscópio para ajudar na exposição durante o procedimento.
Inicia-se com a marcação da área ao redor da lesão através de pequenos pontos com o eletrocautério e assim delimitar os limites de ressecção embora alguns profissionais não a utilize. Na maioria dos casos, a incisão da mucosa é iniciada a partir da extremidade mais distante, para determinar o limite distal de ressecção.
Para usar a vantagem da gravidade, alterna a posição do paciente. Alterna-se a utilização dos acessórios de acordo com a necessidade durante o procedimento até a completa ressecção de lesões de praticamente qualquer tamanho.
Acessórios usados:
ᴥ» Para dissecção: I-T Knife II, Hook knife e Flex-knife;
ᴥ» Para hemostasia: pinça hemostática e HemoClips;
ᴥ» Para manter o cólon e reto distendido: bomba de CO2;
ᴥ» Para produzir a corrente de corte: bisturi elétrico de alta frequência com a função endocut o que propicia uma corrente pulsátil.
ᴥ» Para o colonoscópio: cateter injetor de água externa preso na ponta do aparelho por um “cap” transparente.
ᴥ» Para dissecção: I-T Knife II, Hook knife e Flex-knife;
ᴥ» Para hemostasia: pinça hemostática e HemoClips;
ᴥ» Para manter o cólon e reto distendido: bomba de CO2;
ᴥ» Para produzir a corrente de corte: bisturi elétrico de alta frequência com a função endocut o que propicia uma corrente pulsátil.
ᴥ» Para o colonoscópio: cateter injetor de água externa preso na ponta do aparelho por um “cap” transparente.
A tatuagem consiste na injeção de um agente de coloração permanente na parede intestinal para criar uma marca que identificará o local de dentro ou de fora da luz; normalmente é feito com pelo menos duas injeções de corante nos lados contralaterais do intestino próximo à lesão. A tatuagem deve ser realizada alguns centímetros distais à lesão.
As duas principais indicações são:
1- Para marcar o local da retirada do pólipo, se não tiver certeza de que a remoção foi completa ou se serão necessárias outras sessões para removê-lo, se houver indicadores suspeitos de malignidade e para o controle de recidiva do pólipo, principalmente a retirado em mais de um fragmento (piecemeal).
2- Para identificar o local da lesão durante a cirurgia aberta e principalmente na laparoscópica e robótica (quando se perde o poder da palpação). A localização durante a cirurgia de lesões detectadas pela colonoscopia é imprecisa, quando se baseia na descrição da colonoscopia, levando em último caso, a não ressecção do segmento apropriado.
1- Para marcar o local da retirada do pólipo, se não tiver certeza de que a remoção foi completa ou se serão necessárias outras sessões para removê-lo, se houver indicadores suspeitos de malignidade e para o controle de recidiva do pólipo, principalmente a retirado em mais de um fragmento (piecemeal).
2- Para identificar o local da lesão durante a cirurgia aberta e principalmente na laparoscópica e robótica (quando se perde o poder da palpação). A localização durante a cirurgia de lesões detectadas pela colonoscopia é imprecisa, quando se baseia na descrição da colonoscopia, levando em último caso, a não ressecção do segmento apropriado.
No entanto, se a lesão estiver localizada no reto, no ceco ou próximo à válvula ileocecal, o local não precisa ser tatuado.
Cateter injetor - Produto tradicionalmente disponível para a injeção de outras soluções como de adrenalina ou ethamolin. Introduzido pelo canal de trabalho do aparelho, tem calibre ideal entre 23 – 25 G, com ponta de 3 – 5 mm.
Cateter injetor - Produto tradicionalmente disponível para a injeção de outras soluções como de adrenalina ou ethamolin. Introduzido pelo canal de trabalho do aparelho, tem calibre ideal entre 23 – 25 G, com ponta de 3 – 5 mm.
Recomenda-se uma injeção dupla, com uma solução salina na submucosa para formar uma bolha, seguida de uma injeção de cerca de 1 ml da tinta nanquim esterilizada 1 a 5 % usando uma segunda seringa e completado com mais 1 a 2 ml de solução salina. Parece que esta técnica pode melhorar a eficácia da tatuagem e prevenir complicações inflamatórias e injeção na cavidade abdominal.
Embora a colonoscopia seja considerada um procedimento seguro, não é isenta de riscos. Quase um terço dos pacientes queixam-se de sintomas gastrointestinais transitórios após a colonoscopia como: inchaço abdominal (25%), desconforto abdominal (10,5%), diarreia (6,3%), náusea (4%) e sangramento discreto (3,8%). Felizmente, as complicações graves são incomuns e incluem perfuração, hemorragia, complicações da sedação, complicações do preparo, complicações relacionadas a punção venosa, síndrome de coagulação pós-polipectomia e (raramente) ruptura esplênica.
O risco de complicações graves, sangramento e perfuração, após a colonoscopia é baixo. Nas colonoscopias de rastreamento, complicações graves variam de 1,98 a 2,8 por 1000 exames. Mais de 85% destas complicações ocorrem no cenário da polipectomia.
Os índices de mortalidade variam entre 0,006% e 0,5% e relacionam-se a complicações, como perfuração e hemorragia, principalmente em pacientes com graves comorbidades.
No entanto, o risco de colonoscopia não é constante entre os grupos. Os idosos têm maior risco de complicações graves em comparação com pacientes mais jovens. Pacientes com idade entre 80 e 84 anos têm uma taxa mais alta de complicações graves em comparação com pacientes com idade entre 66 e 69 anos (8.8 por 1000 procedimentos versus 5.0 por 1.000 procedimentos). O risco de complicações graves também está aumentado nos pacientes com certas doenças como: acidente vascular cerebral, doença pulmonar obstrutiva crônica, fibrilação atrial e insuficiência cardíaca.
A grande maioria das pessoas volta ao normal rapidamente e não sofre nenhuma dor ou desconforto grave durante ou após uma colonoscopia – e o exame pode salvar sua vida. Se você tem mais de 45 anos ou tem histórico familiar de câncer colorretal, converse com seu médico hoje sobre quando deve fazer a sua colonoscopia.
O risco de complicações graves, sangramento e perfuração, após a colonoscopia é baixo. Nas colonoscopias de rastreamento, complicações graves variam de 1,98 a 2,8 por 1000 exames. Mais de 85% destas complicações ocorrem no cenário da polipectomia.
Os índices de mortalidade variam entre 0,006% e 0,5% e relacionam-se a complicações, como perfuração e hemorragia, principalmente em pacientes com graves comorbidades.
No entanto, o risco de colonoscopia não é constante entre os grupos. Os idosos têm maior risco de complicações graves em comparação com pacientes mais jovens. Pacientes com idade entre 80 e 84 anos têm uma taxa mais alta de complicações graves em comparação com pacientes com idade entre 66 e 69 anos (8.8 por 1000 procedimentos versus 5.0 por 1.000 procedimentos). O risco de complicações graves também está aumentado nos pacientes com certas doenças como: acidente vascular cerebral, doença pulmonar obstrutiva crônica, fibrilação atrial e insuficiência cardíaca.
A grande maioria das pessoas volta ao normal rapidamente e não sofre nenhuma dor ou desconforto grave durante ou após uma colonoscopia – e o exame pode salvar sua vida. Se você tem mais de 45 anos ou tem histórico familiar de câncer colorretal, converse com seu médico hoje sobre quando deve fazer a sua colonoscopia.
Sangramento colorretal complicando a colonoscopia
Manejo e prevenção de sangramento após colonoscopia com polipectomia
Manejo e prevenção de sangramento após colonoscopia com polipectomia
Um achado importante das revisões sistemáticas recentes é a diminuição nos últimos 15 anos das taxas de “sangramento” pós-colonoscopia clinicamente significativo. Isso contrasta com o aumento substancial da taxa geral de polipectomia, especialmente ressecção endoscópica de pólipos maiores não pediculados (previamente encaminhados para cirurgia). Intuitivamente, o aumento da quantidade e a dificuldade técnica das polipectomias levariam a um maior índice de complicações hemorrágicas.
Apesar dos procedimentos mais frequentes e desafiadores, existe uma tendência estabilizadora para “perfurações” e “mortalidade” e uma taxa decrescente de “sangramento” pós-colonoscopia. Esses resultados são provavelmente devido ao avanço tecnológico dos equipamentos para colonoscopia, melhora da técnica de realização da colonoscopia e retirada de pólipos e especialmente na evolução da formação e treinamento do colonoscopista.
A incidência geral do sangramento varia de 1 a 6 por 1.000 colonoscopias com retirada de pólipos. O tamanho do pólipo é relatado como o fator de risco mais relevante para o sangramento pós-polipectomia. Fatores de risco adicionais incluem o número de pólipos removidos, terapia recente com varfarina, pólipos retirados do lado direito do cólon e histologia de pólipos (adenoma viloso). O risco de sangramento pós-polipectomia é maior em pacientes com trombocitopenia ou coagulopatias.
As sociedades de coloproctologia e endoscopia recomendam diretrizes práticas para otimizar a eficácia e a segurança da polipectomia de rotina. Quando a colonoscopia é realizada por um não especialista (coloproctologista ou endoscopista) as complicações comuns são mais frequentes e a perda de lesões e pólipos são maiores impactando no aumento do diagnóstico dos carcinomas de intervalo, aquele câncer de intestino que surgem entre os intervalos recomendados das colonoscopias.
Estudos relataram que um volume de procedimentos >300 colonoscopias por ano está significativamente associado à diminuição dos riscos de complicações. Colonoscopistas com alto volume de exames têm um papel significativo no treinamento de novos profissionais.
Quase todos os sangramentos são complicações da retirada de pólipos (polipectomia ou mucosectomia). Sangramento após uma colonoscopia diagnóstica é muito raro e se ocorrer, geralmente está associado à biópsia. Isso pode ocorrer quando a estrutura do vaso sanguíneo é biopsiada diretamente, especialmente em pacientes com alteração na coagulação do sangue. Também raramente é visto em casos de fricção mecânica severa pelo colonoscópio.
Apesar dos procedimentos mais frequentes e desafiadores, existe uma tendência estabilizadora para “perfurações” e “mortalidade” e uma taxa decrescente de “sangramento” pós-colonoscopia. Esses resultados são provavelmente devido ao avanço tecnológico dos equipamentos para colonoscopia, melhora da técnica de realização da colonoscopia e retirada de pólipos e especialmente na evolução da formação e treinamento do colonoscopista.
A incidência geral do sangramento varia de 1 a 6 por 1.000 colonoscopias com retirada de pólipos. O tamanho do pólipo é relatado como o fator de risco mais relevante para o sangramento pós-polipectomia. Fatores de risco adicionais incluem o número de pólipos removidos, terapia recente com varfarina, pólipos retirados do lado direito do cólon e histologia de pólipos (adenoma viloso). O risco de sangramento pós-polipectomia é maior em pacientes com trombocitopenia ou coagulopatias.
As sociedades de coloproctologia e endoscopia recomendam diretrizes práticas para otimizar a eficácia e a segurança da polipectomia de rotina. Quando a colonoscopia é realizada por um não especialista (coloproctologista ou endoscopista) as complicações comuns são mais frequentes e a perda de lesões e pólipos são maiores impactando no aumento do diagnóstico dos carcinomas de intervalo, aquele câncer de intestino que surgem entre os intervalos recomendados das colonoscopias.
Estudos relataram que um volume de procedimentos >300 colonoscopias por ano está significativamente associado à diminuição dos riscos de complicações. Colonoscopistas com alto volume de exames têm um papel significativo no treinamento de novos profissionais.
Quase todos os sangramentos são complicações da retirada de pólipos (polipectomia ou mucosectomia). Sangramento após uma colonoscopia diagnóstica é muito raro e se ocorrer, geralmente está associado à biópsia. Isso pode ocorrer quando a estrutura do vaso sanguíneo é biopsiada diretamente, especialmente em pacientes com alteração na coagulação do sangue. Também raramente é visto em casos de fricção mecânica severa pelo colonoscópio.
Fatores de risco para sangramento pós-polipectomia
Os fatores relacionados ao pólipo incluem: tamanho do pólipo, morfologia do pólipo e localização do pólipo no cólon.
Um dos principais fatores de risco relacionados ao pólipo é o seu tamanho. Em um estudo que investigou a retirada de pólipos pediculados, a taxa de sangramento pós-polipectomia imediato e/ou tardio foi de 3,1% para pólipos de 1 a 1,9 cm, enquanto para pólipos com 2 cm ou mais foi de 15,1%. O aumento do risco de sangramento pós-polipectomia também está associado à morfologia do pólipo, sendo mais frequentes nos pólipos pediculados e lesões de crescimento lateral (LST) com mais de 2 cm. Pólipos localizados no lado direito do cólon também apresentam um risco maior de sangramento. Atenção aos grandes pólipos localizados no cólon direito!!!
Fatores relacionados ao paciente incluem idade acima de 65 anos, história de doença cardiovascular e o uso de agentes antiplaquetários e anticoagulantes.
Um estudo retrospectivo focado especificamente no uso de anticoagulação durante a colonoscopia constatou que o sangramento pós-polipectomia tardio ocorreu em 2,6% dos indivíduos com varfarina interrompida somente para a polipectomia e retornando no dia seguinte em comparação com 0,2% dos indivíduos que não usavam nenhum medicamento anticoagulante. Uma metanálise mostrou que a polipectomia em pacientes usando clopidogrel aumenta significativamente o risco de sangramento pós-polipectomia tardio. Embora tienopiridinas e varfarina aumentam o risco de sangramento pós-polipectomia, é importante lembrar que o risco de sangramento pós-polipectomia não altera em pacientes usando apenas aspirina ou anti-inflamatórios não esteroidais (AINEs) isoladamente.
Fatores relacionados ao médico incluem as técnicas escolhidas para a remoção dos pólipos.
Acredita-se que o uso de alça com eletrocautério (alça quente) em oposição a alça sem cauterização (alça a frio) tenha um risco maior de sangramento pós-polipectomia tardio. Embora isso não tenha sido bem estudado para a remoção de pólipos grandes, várias séries de casos relataram taxas muito baixas de sangramento tardio após a remoção com alça fria. Outra técnica, o uso profilático dos clipes, ganhou popularidade nos últimos anos com o pensamento que a colocação rotineira de clipes após polipectomia, especialmente para pólipos grandes, pode reduzir o risco de sangramento tardio. No entanto, além de um estudo retrospectivo que se mostrou promissor, essa prática ainda não foi confirmada como benéfica em ensaios randomizados.
Um dos principais fatores de risco relacionados ao pólipo é o seu tamanho. Em um estudo que investigou a retirada de pólipos pediculados, a taxa de sangramento pós-polipectomia imediato e/ou tardio foi de 3,1% para pólipos de 1 a 1,9 cm, enquanto para pólipos com 2 cm ou mais foi de 15,1%. O aumento do risco de sangramento pós-polipectomia também está associado à morfologia do pólipo, sendo mais frequentes nos pólipos pediculados e lesões de crescimento lateral (LST) com mais de 2 cm. Pólipos localizados no lado direito do cólon também apresentam um risco maior de sangramento. Atenção aos grandes pólipos localizados no cólon direito!!!
Fatores relacionados ao paciente incluem idade acima de 65 anos, história de doença cardiovascular e o uso de agentes antiplaquetários e anticoagulantes.
Um estudo retrospectivo focado especificamente no uso de anticoagulação durante a colonoscopia constatou que o sangramento pós-polipectomia tardio ocorreu em 2,6% dos indivíduos com varfarina interrompida somente para a polipectomia e retornando no dia seguinte em comparação com 0,2% dos indivíduos que não usavam nenhum medicamento anticoagulante. Uma metanálise mostrou que a polipectomia em pacientes usando clopidogrel aumenta significativamente o risco de sangramento pós-polipectomia tardio. Embora tienopiridinas e varfarina aumentam o risco de sangramento pós-polipectomia, é importante lembrar que o risco de sangramento pós-polipectomia não altera em pacientes usando apenas aspirina ou anti-inflamatórios não esteroidais (AINEs) isoladamente.
Fatores relacionados ao médico incluem as técnicas escolhidas para a remoção dos pólipos.
Acredita-se que o uso de alça com eletrocautério (alça quente) em oposição a alça sem cauterização (alça a frio) tenha um risco maior de sangramento pós-polipectomia tardio. Embora isso não tenha sido bem estudado para a remoção de pólipos grandes, várias séries de casos relataram taxas muito baixas de sangramento tardio após a remoção com alça fria. Outra técnica, o uso profilático dos clipes, ganhou popularidade nos últimos anos com o pensamento que a colocação rotineira de clipes após polipectomia, especialmente para pólipos grandes, pode reduzir o risco de sangramento tardio. No entanto, além de um estudo retrospectivo que se mostrou promissor, essa prática ainda não foi confirmada como benéfica em ensaios randomizados.
Estratificação do risco de sangramento pós-polipectomia
O risco de sangramento após a retirada de pólipos é estratificado e classificado em duas categorias.
O risco de sangramento após a retirada de pólipos é estratificado e classificado em duas categorias.
- Procedimentos de baixo risco que inclui a colonoscopia diagnóstica com ou sem biópsia de mucosa.
- Procedimentos de alto risco que incluem a colonoscopia com polipectomia e dilatação de estenoses colônicas benignas ou malignas.
Técnicas endoscópicas para prevenir o sangramento pós-polipectomia
Algumas técnicas endoscópicas foram desenvolvidas para prevenir o sangramento pós-polipectomia como a injeção submucosa de solução de adrenalina diluída (1:10.000) na base de qualquer pólipo e dispositivos mecânicos com clipe endoscópico ou endoloop (alça de náilon destacável).
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
Algumas técnicas endoscópicas foram desenvolvidas para prevenir o sangramento pós-polipectomia como a injeção submucosa de solução de adrenalina diluída (1:10.000) na base de qualquer pólipo e dispositivos mecânicos com clipe endoscópico ou endoloop (alça de náilon destacável).
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
Estratificação do risco de sangramento pós-polipectomia
Estratificação do risco de sangramento pós-polipectomia
O risco de sangramento após a retirada de pólipos é estratificado e classificado em duas categorias.
Técnicas endoscópicas para prevenir o sangramento pós-polipectomia
Algumas técnicas endoscópicas foram desenvolvidas para prevenir o sangramento pós-polipectomia como a injeção submucosa de solução de adrenalina diluída (1:10.000) na base de qualquer pólipo e dispositivos mecânicos com clipe endoscópico ou endoloop (alça de náilon destacável).
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
O risco de sangramento após a retirada de pólipos é estratificado e classificado em duas categorias.
- Procedimentos de baixo risco que inclui a colonoscopia diagnóstica com ou sem biópsia de mucosa.
- Procedimentos de alto risco que incluem a colonoscopia com polipectomia e dilatação de estenoses colônicas benignas ou malignas.
Técnicas endoscópicas para prevenir o sangramento pós-polipectomia
Algumas técnicas endoscópicas foram desenvolvidas para prevenir o sangramento pós-polipectomia como a injeção submucosa de solução de adrenalina diluída (1:10.000) na base de qualquer pólipo e dispositivos mecânicos com clipe endoscópico ou endoloop (alça de náilon destacável).
Está amplamente demonstrado o efeito hemostático da adrenalina na prevenção do sangramento pós-polipectomia e o aumento das taxas da ressecção completa de pólipos sésseis, especialmente os grandes pólipos sésseis. O mecanismo do efeito hemostático das injeções submucosas de adrenalina está na redução do fluxo sanguíneo para o pedículo do pólipo devido à vasoconstrição e compressão dos vasos do pólipo. A injeção local de adrenalina reduz significativamente a ocorrência de sangramento global (3,4% vs. 9,0%) e precoce (2,8% vs. 7,7%) pós-polipectomia em comparação com a injeção ou não de solução salina sem adrenalina.
A eficácia dos dispositivos mecânicos (endoloop ou clipe endoscópico) para prevenir o sangramento pós-polipectomia por meio de sua fixação no pedículo do pólipo ou fechamento do defeito da mucosa foi bem estabelecida. No entanto, estudos randomizados controlados não conseguiram demonstrar a eficácia dos clipes na prevenção do sangramento pós-polipectomia tardio. Ambos são usados isoladamente ou em combinação com injeção de adrenalina na base do pedículo.
O endoloop é colocado no pedículo do pólipo da mesma maneira que uma alça de polipectomia, mas depois de apertado é solto ao redor do pedículo. No entanto, existem problemas com os endoloops, como, por ser flexíveis, ter dificuldade em laçar o pólipo ou estrangular adequadamente, quando o sangramento imediato pode ocorrer. Sendo assim, o corte do pólipo com o eletrocautério deve ser realizado alguns minutos após o endolop ser apertado, tempo necessário para que o endoscopista perceba a alteração da cor da cabeça do pólipo de vermelho vivo para violáceo, demostrando diminuição significativa do fluxo de sangue.
O endoloop é colocado no pedículo do pólipo da mesma maneira que uma alça de polipectomia, mas depois de apertado é solto ao redor do pedículo. No entanto, existem problemas com os endoloops, como, por ser flexíveis, ter dificuldade em laçar o pólipo ou estrangular adequadamente, quando o sangramento imediato pode ocorrer. Sendo assim, o corte do pólipo com o eletrocautério deve ser realizado alguns minutos após o endolop ser apertado, tempo necessário para que o endoscopista perceba a alteração da cor da cabeça do pólipo de vermelho vivo para violáceo, demostrando diminuição significativa do fluxo de sangue.
Um ou mais clipes endoscópicos são colocados na base do pedículo imediatamente antes da polipectomia. A principal vantagem dessa abordagem é que os clipes endoscópicos geralmente são fáceis de colocar. As desvantagens incluem a frequente necessidade de usar vários clipes nos pedículos muito grandes e, de fato, pode ser inviável quando os clipes endoscópicos podem não ter tamanho suficiente para pegar todo o pedículo, mesmo quando vários clipes são aplicados. Outra desvantagem é o processo inflamatório que pode surgir em torno dos clipes que não caem dificultando a diferenciação com pólipo residual nas colonoscopias de controle.
Sangramento pós-polipectomia imediato e tardio
O sangramento imediato é definido como aquele que ocorre nas primeiras 24 horas após a colonoscopia e o sangramento tardio como aquele que ocorre de 24 horas a 14 dias após a colonoscopia.
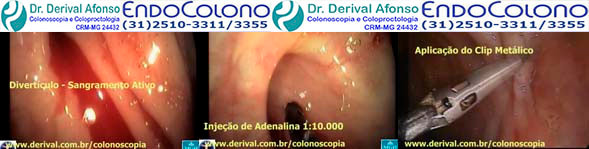
O sangramento pós-polipectomia imediato é aquele reconhecido durante o procedimento, quando normalmente pode ser tratado imediatamente usando técnicas de hemostasia endoscópica como: injeção de adrenalina, clipes, ligaduras e cautério ou dentro das primeiras 24 horas pós procedimento, quando pode ser controlado por nova colonoscopia sem preparo, já que o sangue é laxante. Geralmente o local do sangramento é facilmente identificado nesta nova colonoscopia, porque foi descrito anatomicamente no exame anterior, quando então, pode ser tratada endoscopicamente.
O mecanismo de sangramento pós-polipectomia imediato varia de acordo com a morfologia do pólipo. No caso de pólipos pediculados um grande vaso de alimentação passa pelo pedículo e uma eletrocoagulação insuficiente durante o corte do pedículo com alça pode causar sangramento arterial em jato. No caso de pólipos sésseis um corte profundo e amplo pode resultar em eletrocoagulação insuficiente e resultar em sangramento no leito da lesão.
O sangramento pós-polipectomia tardio é tipicamente observado cinco a sete dias após o procedimento, mas pode ocorrer no período de até quatro semanas. Existem duas causas principais para sangramento pós-polipectomia tardio:
1- Devido à descamação da escara ou crosta que cobria um vaso sanguíneo. A descamação da crosta é uma parte normal do processo de cicatrização e pode ser espontânea ou relacionada à passagem de fezes pela sua superfície;
2- Devido ao aumento da área de necrose causada pela cauterização utilizada para ressecar o pólipo e cauterizar o local da polipectomia. Durante os primeiros dias após o procedimento, a área de necrose aumenta até o nível do tecido não lesado, e geralmente é mais profunda em comparação com o que é visualizado no momento da polipectomia. A necrose geralmente envolve algum grau da submucosa, o que pode levar à hemorragia caso se estenda para um vaso sanguíneo. ou devido à extensão da área de necrose térmica.
Os pacientes podem apresentar enterorragia ou hematoquezia (sangue vivo ou marrom) ou melena (sangue escuro), dependendo da localização e intensidade do sangramento (o sangramento do cólon direito pode se apresentar como melena). Alguns pacientes apresentam sinais de hipovolemia, como taquicardia ou hipotensão, embora muitos pacientes permaneçam hemodinamicamente estáveis. A hemoglobina inicial em pacientes com sangramento agudo pós-polipectomia normalmente estará na linha de base do paciente. Em 24 horas ou mais após a apresentação, a hemoglobina refletirá a quantidade de perda de sangue. O sangramento tardio pós-polipectomia é considerado clinicamente importante se resultar em hospitalização ou transfusão de sangue, ou se uma colonoscopia ou cirurgia seja realizada para tratar o local do sangramento.
A grande maioria dos sangramentos imediatos ou tardios podem ser controlados com segurança pela colonoscopia com várias técnicas hemostáticas, incluindo a colocação de clipes. Assim, o tratamento cirúrgico raramente é necessário.
Tratamento do sangramento imediato após a retirada de pólipo
Tratamento do sangramento imediato pós-polipectomia
Como eu faço para tratar o sangramento imediato pós-polipectomia?
O sangramento imediato pode ser controlado com várias técnicas endoscópicas. A técnica depende da gravidade do sangramento, do tipo de pólipo e da preferência individual. Além disso, pode ser necessária uma combinação de técnicas (por exemplo, injeção de adrenalina diluída e colocação de clipe endoscópico).
Pacientes cujas polipectomias foram realizadas ambulatorialmente podem ser encaminhados para casa após a hemostasia, desde que o paciente tenha permanecido hemodinamicamente estável durante todo o episódio de sangramento e durante o período de observação pós-procedimento.
Sangramento após a remoção de pólipo pediculado - Sangramento pós-polipectomia imediato de pólipo pediculado
Para pólipos pediculados, o sangramento imediato pós-polipectomia geralmente é controlado ao laçar o pedículo residual com a alça de polipectomia, mantendo a compressão máxima durante 5 minutos. Isso interrompe o fluxo sanguíneo e geralmente resultará em hemostasia. Se o sangramento voltar ao afrouxar a alça, reaplicar a pressão por mais cinco minutos geralmente resultará na cessação definitiva do sangramento. O corte com cautério do pedículo residual não é uma abordagem recomendada, pois pode não existir pedículo remanescente suficiente para capturar, além de um risco aumentado de perfuração. Uma vez que o sangramento ativo é controlado geralmente não há mais sangramento.
Quando pólipos pediculados são ressecados, mesmo que exista um pedículo longo, o pedículo residual pode retrair rapidamente deixando uma área plano no sítio da polipectomia. O fenômeno do desaparecimento do pedículo pode resultar em uma situação em que não há pedículo remanescente na parede do cólon para ser capturado com uma alça.
Para pacientes com pedículos remanescentes nos quais o sangramento não pôde ser controlado com a manobra de colocação da alça e aqueles em que o pedúnculo residual não pôde ser capturado, medidas adicionais, como colocação de clipe endoscópico, injeção submucosa de adrenalina diluída e coagulação térmica, são usadas para conseguir a hemostasia. Esses métodos adicionais, que também são usados para tratar o sangramento após a remoção de um pólipo séssil, são discutidos abaixo. (Consulte 'Sangramento após a remoção de pólipos sésseis' abaixo.)
Sangramento após a remoção de pólipo séssil - Sangramento pós-polipectomia imediato de pólipo séssil
Para pacientes com sangramento após a remoção de um pólipo séssil, o tratamento inicial geralmente é pela colocação de clipe endoscópico ou coagulação térmica. Qualquer uma dessas modalidades pode ser usada como monoterapia ou pode ser combinada com terapia de injeção com adrenalina diluída.
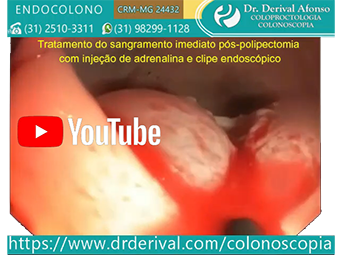
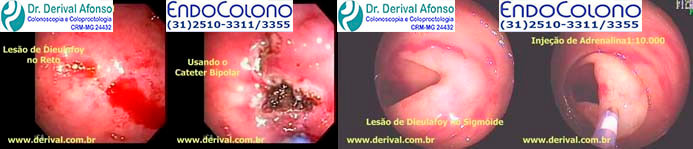
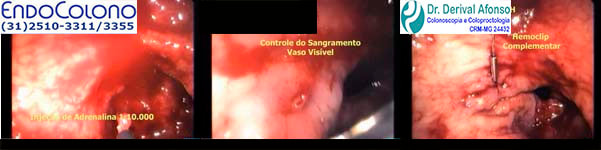
●Adrenalina – A terapia de injeção é normalmente usada em conjunto com outras formas de tratamento, como colocação de clipe endoscópico ou coagulação térmica, embora a terapia de injeção possa ser usada isoladamente em pacientes com sangramento discreto. A adrenalina diluída em solução salina de 1:10.000 a 1:20.000 é injetada na submucosa em volume de 0,5 a 2,0 mL nos quatro quadrantes dentro de 3 mm em torno do local do sangramento. Em pacientes com risco aumentado de ter um evento adverso com injeção de adrenalina, como aqueles com doença cardiovascular, uma diluição de 1:100.000 pode ser usada. O efeito terapêutico das injeções é o tamponamento local no sítio do sangramento e o espasmo do vaso sangrante induzido pela adrenalina.
O sangramento imediato é definido como aquele que ocorre nas primeiras 24 horas após a colonoscopia e o sangramento tardio como aquele que ocorre de 24 horas a 14 dias após a colonoscopia.
O sangramento pós-polipectomia imediato é aquele reconhecido durante o procedimento, quando normalmente pode ser tratado imediatamente usando técnicas de hemostasia endoscópica como: injeção de adrenalina, clipes, ligaduras e cautério ou dentro das primeiras 24 horas pós procedimento, quando pode ser controlado por nova colonoscopia sem preparo, já que o sangue é laxante. Geralmente o local do sangramento é facilmente identificado nesta nova colonoscopia, porque foi descrito anatomicamente no exame anterior, quando então, pode ser tratada endoscopicamente.
O mecanismo de sangramento pós-polipectomia imediato varia de acordo com a morfologia do pólipo. No caso de pólipos pediculados um grande vaso de alimentação passa pelo pedículo e uma eletrocoagulação insuficiente durante o corte do pedículo com alça pode causar sangramento arterial em jato. No caso de pólipos sésseis um corte profundo e amplo pode resultar em eletrocoagulação insuficiente e resultar em sangramento no leito da lesão.
O sangramento pós-polipectomia tardio é tipicamente observado cinco a sete dias após o procedimento, mas pode ocorrer no período de até quatro semanas. Existem duas causas principais para sangramento pós-polipectomia tardio:
1- Devido à descamação da escara ou crosta que cobria um vaso sanguíneo. A descamação da crosta é uma parte normal do processo de cicatrização e pode ser espontânea ou relacionada à passagem de fezes pela sua superfície;
2- Devido ao aumento da área de necrose causada pela cauterização utilizada para ressecar o pólipo e cauterizar o local da polipectomia. Durante os primeiros dias após o procedimento, a área de necrose aumenta até o nível do tecido não lesado, e geralmente é mais profunda em comparação com o que é visualizado no momento da polipectomia. A necrose geralmente envolve algum grau da submucosa, o que pode levar à hemorragia caso se estenda para um vaso sanguíneo. ou devido à extensão da área de necrose térmica.
Os pacientes podem apresentar enterorragia ou hematoquezia (sangue vivo ou marrom) ou melena (sangue escuro), dependendo da localização e intensidade do sangramento (o sangramento do cólon direito pode se apresentar como melena). Alguns pacientes apresentam sinais de hipovolemia, como taquicardia ou hipotensão, embora muitos pacientes permaneçam hemodinamicamente estáveis. A hemoglobina inicial em pacientes com sangramento agudo pós-polipectomia normalmente estará na linha de base do paciente. Em 24 horas ou mais após a apresentação, a hemoglobina refletirá a quantidade de perda de sangue. O sangramento tardio pós-polipectomia é considerado clinicamente importante se resultar em hospitalização ou transfusão de sangue, ou se uma colonoscopia ou cirurgia seja realizada para tratar o local do sangramento.
A grande maioria dos sangramentos imediatos ou tardios podem ser controlados com segurança pela colonoscopia com várias técnicas hemostáticas, incluindo a colocação de clipes. Assim, o tratamento cirúrgico raramente é necessário.
Tratamento do sangramento imediato após a retirada de pólipo
Tratamento do sangramento imediato pós-polipectomia
Como eu faço para tratar o sangramento imediato pós-polipectomia?
O sangramento imediato pode ser controlado com várias técnicas endoscópicas. A técnica depende da gravidade do sangramento, do tipo de pólipo e da preferência individual. Além disso, pode ser necessária uma combinação de técnicas (por exemplo, injeção de adrenalina diluída e colocação de clipe endoscópico).
Pacientes cujas polipectomias foram realizadas ambulatorialmente podem ser encaminhados para casa após a hemostasia, desde que o paciente tenha permanecido hemodinamicamente estável durante todo o episódio de sangramento e durante o período de observação pós-procedimento.
Sangramento após a remoção de pólipo pediculado - Sangramento pós-polipectomia imediato de pólipo pediculado
Para pólipos pediculados, o sangramento imediato pós-polipectomia geralmente é controlado ao laçar o pedículo residual com a alça de polipectomia, mantendo a compressão máxima durante 5 minutos. Isso interrompe o fluxo sanguíneo e geralmente resultará em hemostasia. Se o sangramento voltar ao afrouxar a alça, reaplicar a pressão por mais cinco minutos geralmente resultará na cessação definitiva do sangramento. O corte com cautério do pedículo residual não é uma abordagem recomendada, pois pode não existir pedículo remanescente suficiente para capturar, além de um risco aumentado de perfuração. Uma vez que o sangramento ativo é controlado geralmente não há mais sangramento.
Quando pólipos pediculados são ressecados, mesmo que exista um pedículo longo, o pedículo residual pode retrair rapidamente deixando uma área plano no sítio da polipectomia. O fenômeno do desaparecimento do pedículo pode resultar em uma situação em que não há pedículo remanescente na parede do cólon para ser capturado com uma alça.
Para pacientes com pedículos remanescentes nos quais o sangramento não pôde ser controlado com a manobra de colocação da alça e aqueles em que o pedúnculo residual não pôde ser capturado, medidas adicionais, como colocação de clipe endoscópico, injeção submucosa de adrenalina diluída e coagulação térmica, são usadas para conseguir a hemostasia. Esses métodos adicionais, que também são usados para tratar o sangramento após a remoção de um pólipo séssil, são discutidos abaixo. (Consulte 'Sangramento após a remoção de pólipos sésseis' abaixo.)
Sangramento após a remoção de pólipo séssil - Sangramento pós-polipectomia imediato de pólipo séssil
Para pacientes com sangramento após a remoção de um pólipo séssil, o tratamento inicial geralmente é pela colocação de clipe endoscópico ou coagulação térmica. Qualquer uma dessas modalidades pode ser usada como monoterapia ou pode ser combinada com terapia de injeção com adrenalina diluída.
●Adrenalina – A terapia de injeção é normalmente usada em conjunto com outras formas de tratamento, como colocação de clipe endoscópico ou coagulação térmica, embora a terapia de injeção possa ser usada isoladamente em pacientes com sangramento discreto. A adrenalina diluída em solução salina de 1:10.000 a 1:20.000 é injetada na submucosa em volume de 0,5 a 2,0 mL nos quatro quadrantes dentro de 3 mm em torno do local do sangramento. Em pacientes com risco aumentado de ter um evento adverso com injeção de adrenalina, como aqueles com doença cardiovascular, uma diluição de 1:100.000 pode ser usada. O efeito terapêutico das injeções é o tamponamento local no sítio do sangramento e o espasmo do vaso sangrante induzido pela adrenalina.
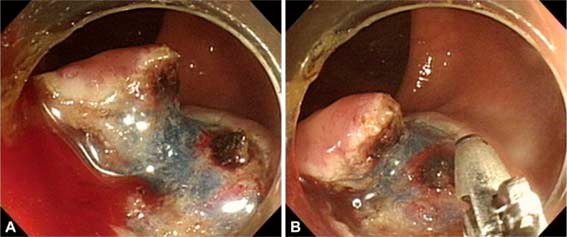
●Clipes endoscópicos – O clipe endoscópico é uma importante opção na hemostasia e tratamento do sangramento imediato pós-polipectomia. Para sangramento no local de remoção de um pólipo séssil (ou seja, local plano), o clipe endoscópico é aplicado primeiro diretamente no ponto do sangramento. Após o controle da hemorragia, clipes adicionais podem ser colocados em ambos os lados do clipe inicial para ocluir o vaso de alimentação ou ser usados para fechar o defeito da mucosa, se for grande ou continuar o sangramento em lençol. Para pólipos pediculados os clipes endoscópicos são aplicados diretamente no pedículo residual.
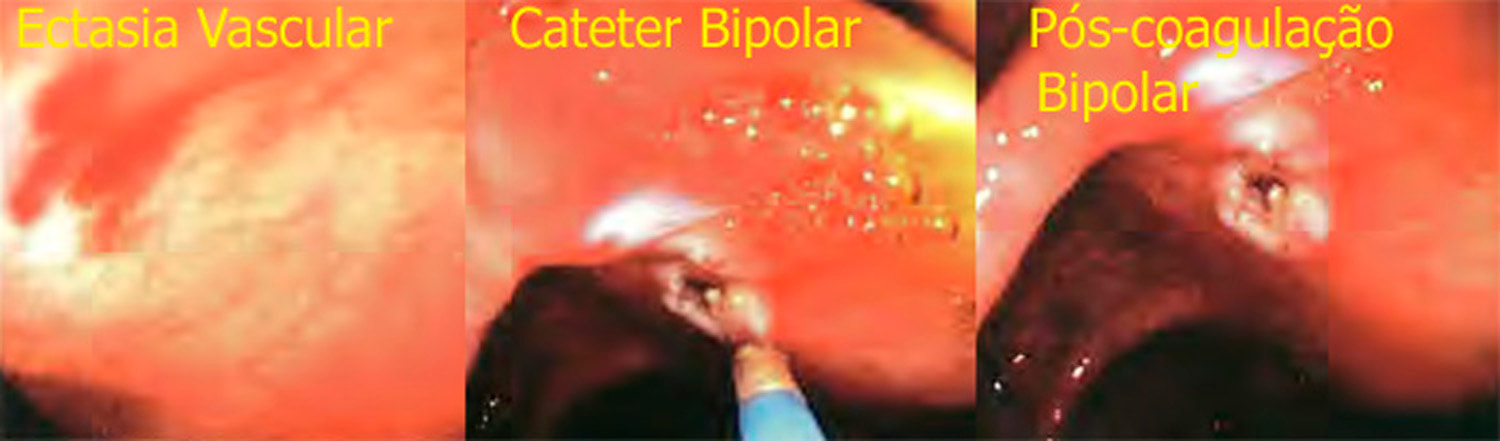
●Coagulação térmica – A aplicação de coagulação térmica no local do sangramento resulta em hemostasia, e normalmente é realizada com uma sonda de contato, como a sonda de eletrocoagulação bipolar (BICAP) ou a ponta de uma alça de polipectomia. Quando uma sonda bipolar é usada, a corrente fornecida deve ser reduzida em aproximadamente 50% (cerca de 10 watts) em relação àquela usada para úlceras hemorrágicas no trato gastrointestinal superior, porque a parede do cólon é muito fina e mais suscetível à perfuração. Quando a ponta da alça de polipectomia é usada, a corrente deve ser ajustada para o modo de coagulação. Para qualquer modalidade térmica recomenda-se que a duração de cada aplicação seja de um a dois segundos. Jato de água através da sonda é extremamente útil para limpar o sangue do local e permitir a localização precisa para usar a sonda.
|
Outra técnica de coagulação térmica é o uso de pinças de coagulação que agarram diretamente o vaso e aplicam uma corrente de coagulação suave. Essa técnica, que utiliza corrente monopolar, é comumente usada para controlar o sangramento na dissecção endoscópica da submucosa (ESD). O vaso sangrante é agarrado com a pinça, "puxado" em direção ao aparelho e uma leve coagulação é aplicada em rajadas curtas de um a dois segundos.
|
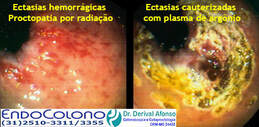
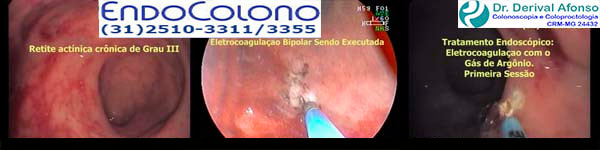
●Outros métodos – Outros métodos para a hemostasia do local do sangramento pós-polipectomia imediato incluem coagulação com plasma de argônio (APC) e ligadura elástica. O sangramento em lençol no local da polipectomia após a remoção de um pólipo séssil grande (≥2 cm) pode ser controlada com coagulação com plasma de argônio.
Tratamento do sangramento tardio após a retirada de pólipo
Tratamento do sangramento tardio pós-polipectomia
Como eu faço para tratar o sangramento tardio pós-polipectomia?
Tratamento do sangramento tardio pós-polipectomia
Como eu faço para tratar o sangramento tardio pós-polipectomia?
Pacientes sem sangramento contínuo pós-polipectomia
Para pacientes com pequeno volume de sangue nas fezes (ou seja, < 50mL) ou param de evacuar sangue após a apresentação inicial, geralmente é seguro adiar a colonoscopia enquanto continua o monitoramento clínico (por exemplo, frequência cardíaca, pressão arterial, níveis seriados de hemoglobina, evacuações).
Se o sangramento parou sem intervenção endoscópica, é incomum que volte. Como resultado, não há necessidade de repetir a colonoscopia para avaliar o local presumido de sangramento em um paciente cujo sangramento parou.
Se ocorrerem evacuações sanguinolentas durante este período de observação, o paciente deve fazer a colonoscopia após o preparo intestinal.
Pacientes com sangramento tardio contínuo pós-polipectomia
A avaliação inicial e o manejo de um paciente com suspeita de sangramento pós-polipectomia tardio são semelhantes à abordagem para pacientes com sangramento gastrointestinal inferior (GI) de outras fontes. Os pacientes devem ser avaliados imediatamente.
Sinais de hipovolemia (taquicardia – FC > 100 bpm, hipotensão postural, sudorese e desmaio) são sugestivos de instabilidade hemodinâmica, e os exames laboratoriais iniciais incluem hemograma completo, bioquímica sérica (função renal – ureia e creatinina, função hepática – gamaGT, TGO e TGP, eletrólitos – K, Ca e Na) e estudos de coagulação. A avaliação do coloproctologista ou endoscopista deve ser obtida no momento da admissão do paciente. A avaliação e o manejo de pacientes com sangramento do trato gastrointestinal inferior, incluindo avaliação clínica, ressuscitação volêmica, transfusão de sangue e tratamento de coagulopatias, são discutidos separadamente.
Para pacientes com sangramento grave pós-polipectomia resultando em instabilidade hemodinâmica (ou seja, taquicardia e/ou hipotensão que não responde à ressuscitação com fluidos ou sangue), a avaliação do cirurgião deve ser solicitada prontamente para uma abordagem multidisciplinar e intervenções adicionais.
Colonoscopia nos pacientes com sangramento tardio contínuo pós-polipectomia
Os pacientes com sangramento contínuo devem ser submetidos à colonoscopia após a ressuscitação e preparo intestinal (normalmente dentro de 24 horas após a admissão), enquanto os pacientes que param de sangrar não precisam da colonoscopia.
Com base na experiência clínica, a frequência com que os pacientes evacuam com sangue é um bom indicador da continuidade do sangramento. As evacuações sanguinolentas que são frequentes (ou seja, ocorrem a cada duas horas) sugerem sangramento ativo, enquanto a cessação do sangramento no local da polipectomia é marcada pela redução progressiva das evacuações sanguinolentas até a parada completa.
Para pacientes hospitalizados com sangramento pós-polipectomia em curso, a preparo intestinal é o mesmo usado para a colonoscopia eletiva iniciando 6 horas antes do exame, embora o sangue dentro da luz do cólon tenha um efeito laxante e possa ajudar no preparo do intestino para o exame.
O cenário ideal para uma colonoscopia de urgência é quando a equipe regular de endoscopia está presente, e isso geralmente ocorre durante o horário habitual de funcionamento da unidade de endoscopia. Por exemplo, se um paciente apresenta sangramento pós-polipectomia à noite ou nas primeiras horas da manhã, primeiro o paciente é estabilizado para depois realizar o preparo intestinal e quando completo a colonoscopia é realizada. O paciente é monitorado durante todo o tempo.
Tratamento endoscópico do tratamento do sangramento pós-polipectomia tardio
A maioria dos pacientes com sangramento pós-polipectomia tardio ativo pode ser tratada com terapia endoscópica e raramente requer intervenção adicional, como cirurgia ou métodos angiográficos (por exemplo, embolização seletiva).
A terapia endoscópica é realizada com a colocação de clipes endoscópicos ou uma modalidade térmica (por exemplo, eletrocautério bipolar), às vezes em combinação com injeção submucosa de adrenalina, conforme discutido anteriormente. Para minimizar potenciais novas lesões da mucosa pela eletrocauterização, normalmente usa-se clipes endoscópicos para controlar o sangramento no local da polipectomia quando a colocação do clipe é tecnicamente viável como descrito acima em sangramento após a remoção do pólipo séssil acima.
A injeção submucosa de adrenalina diluída (1:10.000) é menos eficaz em pacientes com sangramento tardio, em contraste com a injeção no sangramento pós-polipectomia imediato. Porque a resposta inflamatória causa um grau leve a moderado de edema e endurecimento no local da polipectomia dentro de um a dois dias. Isso pode impedir a distensão da submucosa e resultar na incapacidade da solução de adrenalina se infiltrar nos espaços teciduais, fazendo com que a solução líquida injetada escorra pelo orifício da agulha no local da injeção. Por outro lado, o endurecimento e o consequente aumento da espessura da parede do cólon podem tornar o uso de modalidades térmicas mais seguras, de modo que aplicações repetidas da sonda bipolar ou pinça coagulante podem ser usadas para a hemostasia com menos risco de perfuração.
Tratamento do sangramento pós-polipectomia que não responde às medidas endoscópicas
Outras opções incluem terapia angiográfica (por exemplo, embolização seletiva) e cirurgia para remover a porção do cólon que contém o local da polipectomia.
A terapia angiográfica é preferível à cirurgia para pacientes com hemorragia não controlada porque é eficaz, e menos invasiva. A embolização arterial transcateter superseletiva com micromolas tem sido eficaz no controle do sangramento refratário à terapia endoscópica em relatos de casos.
A cirurgia pode ser necessária em pacientes com sangramento persistente após a tentativa do tratamento endoscópico e outras intervenções falham ou não estejam disponíveis. Se apenas um pólipo foi removido, o local do sangramento é identificado pela tatuagem com nanquim realizada na colonoscopia de urgência nos casos em que não se consegue controlar o sangramento por métodos endoscópicos.
Uma colectomia subtotal pode ser necessária se vários pólipos forem removidos em várias áreas do cólon e um exame colonoscópico não puder identificar o local do sangramento da polipectomia.
Resultados do tratamento de pacientes com sangramento pós-polipectomia tardio
Felizmente, para os pacientes que apresentam sangramento pós-polipectomia, essa complicação geralmente não está associada a nenhuma sequela importante a longo prazo. Em um estudo de 1.657 indivíduos submetidos à polipectomia, houve 5 com sangramento pós-polipectomia tardio, todos os quais receberam transfusão de sangue. Todos foram tratados com sucesso por nova colonoscopia. Nenhum desses indivíduos necessitou de cirurgia e nenhum morreu.
Considerações ao encaminhar pacientes com doenças cardiovasculares para colonoscopia
Ao encaminhar pacientes para colonoscopia, é muito importante avaliar cuidadosamente o uso de agentes antiplaquetários ou anticoagulantes e o momento da colonoscopia. O uso de agentes antiplaquetários e anticoagulantes está aumentando devido às altas taxas de doença arterial coronariana e doença cerebrovascular. Ao considerar uma colonoscopia, os riscos de suspender esses medicamentos e, portanto, precipitar eventos trombóticos, devem ser cuidadosamente ponderados em relação aos riscos de continuar esses agentes durante procedimentos endoscópicos que pode ser complicado por sangramento, particularmente procedimentos com intervenções de alto risco de sangramento, como polipectomia.
Além disso, quando o tratamento com agentes que aumentam o risco de sangramento é de curta duração, os procedimentos eletivos devem ser adiados até que a terapia seja concluída. Também deve-se ter em mente que, embora a polipectomia apresente risco de hemorragia, muitos dos pacientes que estão sendo submetidos à colonoscopia para rastreamento ou vigilância do câncer de cólon não precisarão de polipectomia durante a colonoscopia; no entanto, isso não é conhecido até que o procedimento seja concluído. Ao considerar a endoscopia para pacientes em uso de anticoagulantes, várias questões importantes devem ser ponderadas.
Questões a serem consideradas ao avaliar um paciente em uso de agentes anticoagulantes ou antiplaquetários para colonoscopia.
Gerenciamento da ASPIRINA durante a colonoscopia
A aspirina inativa irreversivelmente as plaquetas durante sua vida útil, de 7 a 10 dias. No entanto, com base em vários estudos retrospectivos, as diretrizes concordam que a aspirina pode ser continuada com segurança durante a colonoscopia com polipectomia sem preocupação com um aumento significativo do sangramento. Além disso, os riscos cardiovasculares associados à retirada da aspirina podem ser altos, especialmente em pacientes com história de doença arterial coronariana.
Gerenciamento das TIENOPIRIDINAS (clopidogrel) durante a colonoscopia
As tienopiridinas inibem a função plaquetária. Em pacientes com doença arterial coronariana, especialmente no contexto de stents coronários. As tienopiridinas são mais frequentemente administradas em combinação com aspirina, que é denominada terapia antiplaquetária dupla (DAPT).
Pacientes usando tienopiridinas durante a polipectomia apresentam uma taxa de sangramento pós-polipectomia significativamente maior (2,4%) quando comparados aos demais pacientes (0,3 a 1,2%). O risco é ainda maior quando as tienopiridina estão associadas à aspirina.
Embora o sangramento pós-polipectomia seja uma complicação que possa ser evitada com a suspenção das tienopiridinas, é importante notar que essa complicação tem baixa mortalidade associada, porque geralmente é tratada sem cirurgia e não tem consequências a longo prazo. Portanto, deve-se considerar sempre o risco de eventos tromboembólicos relacionados à retirada de agentes antiplaquetários, incluindo trombose de stent.
As diretrizes de 2016 da American Society for Gastrointestinal Endoscopy (ASGE) recomendam, em geral, a interrupção das tienopiridinas e a manutenção da aspirina para os procedimentos colonoscópicos planejados com alto risco de sangramento, como a polipectomia. No entanto, para pessoas com alto risco de tromboembolismo, deve-se considerar adiar o procedimento colonoscópico até que o risco de descontinuação das tienopiridinas seja menor (por exemplo, esperar até 12 meses após a colocação de um stent coronário farmacológico). Além disso, a urgência do procedimento deve ser ponderada. Por exemplo, adiar a colonoscopia de triagem ou vigilância por no mínimo 12 meses, mas reduzir para 6 meses para um paciente assintomático com anemia por deficiência ferro.
Também deve ser considerada a realização da colonoscopia sem suspender as tienopiridinas após uma cuidadosa ponderação de riscos e benefícios se houver alta urgência para o procedimento. Além disso, para procedimentos endoscópicos considerados de baixo risco de sangramento (por exemplo, colonoscopia diagnóstica para avaliar anemia ferropriva sem plano de polipectomia), a recomendação da ASGE é continuar os agentes durante o procedimento.
Se o adiamento da colonoscopia for considerado desaconselhável, o risco de tromboembolismo não for alto e o procedimento planejado for de alto risco de sangramento, a tienopiridina deve ser descontinuada 5 a 7 dias antes do procedimento. Mas se o risco de tromboembolismo for aumentado recomenda-se o uso de heparina de baixo peso molecular subcutânea como ponte durante os dias de suspensão das tienopiridinas, interrompendo 24 horas antes do exame.
Gerenciamento da Varfarina durante a colonoscopia
A varfarina é um agente anticoagulante comumente usado para o tratamento de uma variedade de distúrbios, incluindo trombose venosa profunda (TVP); embolia pulmonar; acidente vascular cerebral isquêmico; e profilaxia de tromboembolismo arterial de fibrilação atrial, flutter e distúrbios valvulares cardíacos.
É importante lembrar que, embora o objetivo de interromper os anticoagulantes periprocedimento seja reduzir o risco de sangramento, os pacientes que estão em terapia com varfarina ainda apresentam risco aumentado de sangramento pós-procedimento, apesar da retirada do medicamento antes do exame como recomendado.
Um estudo retrospectivo comparou o sangramento pós-polipectomia tardio em indivíduos que interromperam a varfarina com indivíduos que não estavam em uso de varfarina e encontrou taxas significativamente mais altas de sangramento naqueles que usaram varfarina apesar de ter sido retirada para os exames.
Semelhante às recomendações da ASGE para agentes antiplaquetários, a decisão de retirar ou continuar a varfarina durante a colonoscopia baseia-se na avaliação do risco de sangramento do procedimento planejado, o risco de tromboembolismo se a droga for suspensa e a urgência do procedimento. Se o procedimento for de baixo risco de sangramento (p. colonoscopia diagnóstica sem plano de polipectomia), a varfarina pode ser continuada durante o procedimento. Especificamente, a biópsia da mucosa é segura para ser realizada durante a colonoscopia para pacientes em uso de varfarina cuja razão normalizada internacional está na faixa terapêutica (RNI-alvo de 2,0 e 3,0).
No entanto, as diretrizes atuais recomendam que, para procedimentos de alto risco como a polipectomia, a varfarina deve ser interrompida 5 dias antes do exame. Quando é tomada a decisão de descontinuar a varfarina, o risco de tromboembolismo deve ser ponderado na decisão de fazer ou não ponte da varfarina com um anticoagulante de ação curta, como a heparina de baixo peso molecular. Para condições de alto risco de tromboembólico, deve-se considerar adiar o procedimento, principalmente se a duração do tratamento do anticoagulante pode ser alcançada em breve (por exemplo, 6 meses de varfarina para um TVP). Se o adiamento for considerado desaconselhável e o risco de tromboembolismo for alto, a varfarina deve ser descontinuada e iniciada a ponte com heparina de baixo peso molecular e retirada no dia anterior ao procedimento (ou seja, última dose 24 horas antes do procedimento).
Gerenciamento de anticoagulantes orais de ação direta durante a colonoscopia
Os anticoagulantes orais diretos (DOACs) são uma nova classe de anticoagulantes que inibem diretamente a trombina. Dabigatrana - (Pradaxa®) ou o fator Xa Rivaroxabana (Xarelto®), Apixabana (Eliquis®) e Edoxabana (Lixiana®) na cascata da coagulação.
As principais vantagens dos DOACs em relação à varfarina é que não necessitam de monitoramento com exames de sangue, menos interações com a dieta e outros medicamentos e início e eliminação mais rápidos da ação (com função renal normal).
Por outro lado, esses agentes são mais caros que a varfarina e, com a exceção da dabigatrana, não há meios disponíveis para reverter o efeito anticoagulante em caso de sangramento. Semelhante à varfarina, os DOACs aumentam o risco de sangramento de todas as causas. Não relacionado à polipectomia, a taxa de sangramento gastrointestinal (GI) foi maior para indivíduos tratados com dabigatrana (3% vs 2%), rivaroxabana (3,2% vs 2,2%) ou edoxabana (1,5% vs 1,2%) em comparação com indivíduos que tomam varfarina.
A razão para o risco aumento de sangramento GI com os DOACs não é claro. Nenhum estudo explorou especificamente taxas de sangramento com procedimentos endoscópicos de alto risco, como polipectomia; no entanto, um pequeno estudo japonês descobriu que a biópsia endoscópica da mucosa parece ser segura para pacientes em uso de dabigatrana.
As diretrizes mais recentes da ASGE (2016) incluíram recomendações sobre a gestão dos DOACs nos exames endoscópicos. Tal como acontece com outros agentes antiplaquetários e anticoagulantes, para procedimentos com baixo risco de sangramento, os DOACs provavelmente podem ser mantidos com segurança. Para procedimentos com alto risco de sangramento, como a polipectomia, os DOACs devem ser retirados antes do exame. Dado o rápido início e eliminação (com função renal normal) desses agentes, não há necessidade de ponte periprocedimento. As diretrizes recomendam manter esses agentes por 2 a 3 meias-vidas antes do procedimento (1 a 2 dias). Para pacientes com doença renal leve a moderada (clearance de creatinina <50 mL/min), o medicamento deve ser retirado 3 a 5 dias antes do procedimento. Geralmente, após o procedimento, o agente pode ser readministrado imediatamente ou dentro de vários dias, dependendo do risco de sangramento para a intervenção que foi realizada.
Quando readministrar as drogas anticoagulantes após o procedimento
Após tomar a decisão de descontinuar um antiplaquetário ou anticoagulante em preparação para um procedimento endoscópico, a próxima decisão importante é quando readministrar o medicamento após o procedimento. Infelizmente, as diretrizes não fornecem um consenso claro porque há muitos poucos estudos para basear as recomendações.
Para tienopiridinas, o ACC/ACG (diretrizes conjuntas do American College of Cardiology e American College of Gastroenterology) recomendam a readministração “assim que possível”, a ASGE recomenda o tempo com base na ponderação dos riscos de doença tromboembólica com a suspensão da medicação e os riscos de sangramento com base no procedimento realizado com readministração imediata, e a Sociedade Britânica de Gastroenterologia recomenda a readministração no dia seguinte ao procedimento. Todas essas recomendações são baseadas em opinião porque não há dados definitivos para orientar essas decisões.
Ao readministrar uma tienopiridina, outra questão controversa é se existe a necessidade de uma dose de ataque da droga (para obter níveis terapêuticos mais rápidos). Ao readministrar o clopidogrel em sua dose oral usual (75 mg ao dia), leva de 5 a 10 dias para atingir inibição plaquetária máxima, em comparação com 12 a 15 horas se o paciente receber 300 a 600 mg. A diretriz do JACC/ACG recomenda que a decisão quanto à necessidade da dose de ataque baseia-se no risco de doença tromboembólicos.
Para pacientes que estavam em uso de varfarina sem ponte, as diretrizes da ASGE recomendam a readministração da varfarina em 24 horas. Para os pacientes que estavam em varfarina que foi ponteada, a varfarina deve ser readministrada na noite do procedimento, enquanto a heparina deve ser retomada o mais rápido possível após o procedimento e retirada assim que o RNI se tornar terapêutico. No entanto, o ajuste dessas diretrizes deve ser caso a caso no cenário de procedimentos de alto risco de sangramento, como grandes polipectomias, porque mesmo a reintrodução da varfarina após 7 dias da polipectomia é fator de risco para sangramento pós-polipectomia tardio.
Para pacientes em uso de DOACs, a ASGE recomenda que esses agentes também sejam readministrados o mais rápido possível. Nos casos em que não podem ser readministrados dentro de 24 horas devido à preocupação com alto risco de sangramento, deve-se considerar a ponte com heparina para aqueles com alto risco tromboembólico.
Para pacientes com pequeno volume de sangue nas fezes (ou seja, < 50mL) ou param de evacuar sangue após a apresentação inicial, geralmente é seguro adiar a colonoscopia enquanto continua o monitoramento clínico (por exemplo, frequência cardíaca, pressão arterial, níveis seriados de hemoglobina, evacuações).
Se o sangramento parou sem intervenção endoscópica, é incomum que volte. Como resultado, não há necessidade de repetir a colonoscopia para avaliar o local presumido de sangramento em um paciente cujo sangramento parou.
Se ocorrerem evacuações sanguinolentas durante este período de observação, o paciente deve fazer a colonoscopia após o preparo intestinal.
Pacientes com sangramento tardio contínuo pós-polipectomia
A avaliação inicial e o manejo de um paciente com suspeita de sangramento pós-polipectomia tardio são semelhantes à abordagem para pacientes com sangramento gastrointestinal inferior (GI) de outras fontes. Os pacientes devem ser avaliados imediatamente.
Sinais de hipovolemia (taquicardia – FC > 100 bpm, hipotensão postural, sudorese e desmaio) são sugestivos de instabilidade hemodinâmica, e os exames laboratoriais iniciais incluem hemograma completo, bioquímica sérica (função renal – ureia e creatinina, função hepática – gamaGT, TGO e TGP, eletrólitos – K, Ca e Na) e estudos de coagulação. A avaliação do coloproctologista ou endoscopista deve ser obtida no momento da admissão do paciente. A avaliação e o manejo de pacientes com sangramento do trato gastrointestinal inferior, incluindo avaliação clínica, ressuscitação volêmica, transfusão de sangue e tratamento de coagulopatias, são discutidos separadamente.
Para pacientes com sangramento grave pós-polipectomia resultando em instabilidade hemodinâmica (ou seja, taquicardia e/ou hipotensão que não responde à ressuscitação com fluidos ou sangue), a avaliação do cirurgião deve ser solicitada prontamente para uma abordagem multidisciplinar e intervenções adicionais.
Colonoscopia nos pacientes com sangramento tardio contínuo pós-polipectomia
Os pacientes com sangramento contínuo devem ser submetidos à colonoscopia após a ressuscitação e preparo intestinal (normalmente dentro de 24 horas após a admissão), enquanto os pacientes que param de sangrar não precisam da colonoscopia.
Com base na experiência clínica, a frequência com que os pacientes evacuam com sangue é um bom indicador da continuidade do sangramento. As evacuações sanguinolentas que são frequentes (ou seja, ocorrem a cada duas horas) sugerem sangramento ativo, enquanto a cessação do sangramento no local da polipectomia é marcada pela redução progressiva das evacuações sanguinolentas até a parada completa.
Para pacientes hospitalizados com sangramento pós-polipectomia em curso, a preparo intestinal é o mesmo usado para a colonoscopia eletiva iniciando 6 horas antes do exame, embora o sangue dentro da luz do cólon tenha um efeito laxante e possa ajudar no preparo do intestino para o exame.
O cenário ideal para uma colonoscopia de urgência é quando a equipe regular de endoscopia está presente, e isso geralmente ocorre durante o horário habitual de funcionamento da unidade de endoscopia. Por exemplo, se um paciente apresenta sangramento pós-polipectomia à noite ou nas primeiras horas da manhã, primeiro o paciente é estabilizado para depois realizar o preparo intestinal e quando completo a colonoscopia é realizada. O paciente é monitorado durante todo o tempo.
Tratamento endoscópico do tratamento do sangramento pós-polipectomia tardio
A maioria dos pacientes com sangramento pós-polipectomia tardio ativo pode ser tratada com terapia endoscópica e raramente requer intervenção adicional, como cirurgia ou métodos angiográficos (por exemplo, embolização seletiva).
A terapia endoscópica é realizada com a colocação de clipes endoscópicos ou uma modalidade térmica (por exemplo, eletrocautério bipolar), às vezes em combinação com injeção submucosa de adrenalina, conforme discutido anteriormente. Para minimizar potenciais novas lesões da mucosa pela eletrocauterização, normalmente usa-se clipes endoscópicos para controlar o sangramento no local da polipectomia quando a colocação do clipe é tecnicamente viável como descrito acima em sangramento após a remoção do pólipo séssil acima.
A injeção submucosa de adrenalina diluída (1:10.000) é menos eficaz em pacientes com sangramento tardio, em contraste com a injeção no sangramento pós-polipectomia imediato. Porque a resposta inflamatória causa um grau leve a moderado de edema e endurecimento no local da polipectomia dentro de um a dois dias. Isso pode impedir a distensão da submucosa e resultar na incapacidade da solução de adrenalina se infiltrar nos espaços teciduais, fazendo com que a solução líquida injetada escorra pelo orifício da agulha no local da injeção. Por outro lado, o endurecimento e o consequente aumento da espessura da parede do cólon podem tornar o uso de modalidades térmicas mais seguras, de modo que aplicações repetidas da sonda bipolar ou pinça coagulante podem ser usadas para a hemostasia com menos risco de perfuração.
Tratamento do sangramento pós-polipectomia que não responde às medidas endoscópicas
Outras opções incluem terapia angiográfica (por exemplo, embolização seletiva) e cirurgia para remover a porção do cólon que contém o local da polipectomia.
A terapia angiográfica é preferível à cirurgia para pacientes com hemorragia não controlada porque é eficaz, e menos invasiva. A embolização arterial transcateter superseletiva com micromolas tem sido eficaz no controle do sangramento refratário à terapia endoscópica em relatos de casos.
A cirurgia pode ser necessária em pacientes com sangramento persistente após a tentativa do tratamento endoscópico e outras intervenções falham ou não estejam disponíveis. Se apenas um pólipo foi removido, o local do sangramento é identificado pela tatuagem com nanquim realizada na colonoscopia de urgência nos casos em que não se consegue controlar o sangramento por métodos endoscópicos.
Uma colectomia subtotal pode ser necessária se vários pólipos forem removidos em várias áreas do cólon e um exame colonoscópico não puder identificar o local do sangramento da polipectomia.
Resultados do tratamento de pacientes com sangramento pós-polipectomia tardio
Felizmente, para os pacientes que apresentam sangramento pós-polipectomia, essa complicação geralmente não está associada a nenhuma sequela importante a longo prazo. Em um estudo de 1.657 indivíduos submetidos à polipectomia, houve 5 com sangramento pós-polipectomia tardio, todos os quais receberam transfusão de sangue. Todos foram tratados com sucesso por nova colonoscopia. Nenhum desses indivíduos necessitou de cirurgia e nenhum morreu.
Considerações ao encaminhar pacientes com doenças cardiovasculares para colonoscopia
Ao encaminhar pacientes para colonoscopia, é muito importante avaliar cuidadosamente o uso de agentes antiplaquetários ou anticoagulantes e o momento da colonoscopia. O uso de agentes antiplaquetários e anticoagulantes está aumentando devido às altas taxas de doença arterial coronariana e doença cerebrovascular. Ao considerar uma colonoscopia, os riscos de suspender esses medicamentos e, portanto, precipitar eventos trombóticos, devem ser cuidadosamente ponderados em relação aos riscos de continuar esses agentes durante procedimentos endoscópicos que pode ser complicado por sangramento, particularmente procedimentos com intervenções de alto risco de sangramento, como polipectomia.
Além disso, quando o tratamento com agentes que aumentam o risco de sangramento é de curta duração, os procedimentos eletivos devem ser adiados até que a terapia seja concluída. Também deve-se ter em mente que, embora a polipectomia apresente risco de hemorragia, muitos dos pacientes que estão sendo submetidos à colonoscopia para rastreamento ou vigilância do câncer de cólon não precisarão de polipectomia durante a colonoscopia; no entanto, isso não é conhecido até que o procedimento seja concluído. Ao considerar a endoscopia para pacientes em uso de anticoagulantes, várias questões importantes devem ser ponderadas.
Questões a serem consideradas ao avaliar um paciente em uso de agentes anticoagulantes ou antiplaquetários para colonoscopia.
- Qual é a urgência do procedimento?
- A colonoscopia realmente precisa ser realizada imediatamente ou o paciente pode esperar com segurança alguns meses até que os anticoagulantes sejam retirados e/ou o risco de eventos trombóticos seja menor?
- Qual é o risco de sangramento (relacionado ao medicamento e ao procedimento planejado)?
- É provável que o procedimento seja apenas diagnóstico ou inclua uma intervenção com alto risco de sangramento?
- Qual é o risco de interrupção do medicamento (ou seja, evento tromboembólico)?
- O risco de um evento tromboembólico é maior do que o de uma complicação hemorrágica do procedimento endoscópico?
- Se o medicamento for retirado temporariamente, qual é o momento ideal de retirada e retorno do medicamento, e o medicamento precisa ser readministrado?
Gerenciamento da ASPIRINA durante a colonoscopia
A aspirina inativa irreversivelmente as plaquetas durante sua vida útil, de 7 a 10 dias. No entanto, com base em vários estudos retrospectivos, as diretrizes concordam que a aspirina pode ser continuada com segurança durante a colonoscopia com polipectomia sem preocupação com um aumento significativo do sangramento. Além disso, os riscos cardiovasculares associados à retirada da aspirina podem ser altos, especialmente em pacientes com história de doença arterial coronariana.
Gerenciamento das TIENOPIRIDINAS (clopidogrel) durante a colonoscopia
As tienopiridinas inibem a função plaquetária. Em pacientes com doença arterial coronariana, especialmente no contexto de stents coronários. As tienopiridinas são mais frequentemente administradas em combinação com aspirina, que é denominada terapia antiplaquetária dupla (DAPT).
Pacientes usando tienopiridinas durante a polipectomia apresentam uma taxa de sangramento pós-polipectomia significativamente maior (2,4%) quando comparados aos demais pacientes (0,3 a 1,2%). O risco é ainda maior quando as tienopiridina estão associadas à aspirina.
Embora o sangramento pós-polipectomia seja uma complicação que possa ser evitada com a suspenção das tienopiridinas, é importante notar que essa complicação tem baixa mortalidade associada, porque geralmente é tratada sem cirurgia e não tem consequências a longo prazo. Portanto, deve-se considerar sempre o risco de eventos tromboembólicos relacionados à retirada de agentes antiplaquetários, incluindo trombose de stent.
As diretrizes de 2016 da American Society for Gastrointestinal Endoscopy (ASGE) recomendam, em geral, a interrupção das tienopiridinas e a manutenção da aspirina para os procedimentos colonoscópicos planejados com alto risco de sangramento, como a polipectomia. No entanto, para pessoas com alto risco de tromboembolismo, deve-se considerar adiar o procedimento colonoscópico até que o risco de descontinuação das tienopiridinas seja menor (por exemplo, esperar até 12 meses após a colocação de um stent coronário farmacológico). Além disso, a urgência do procedimento deve ser ponderada. Por exemplo, adiar a colonoscopia de triagem ou vigilância por no mínimo 12 meses, mas reduzir para 6 meses para um paciente assintomático com anemia por deficiência ferro.
Também deve ser considerada a realização da colonoscopia sem suspender as tienopiridinas após uma cuidadosa ponderação de riscos e benefícios se houver alta urgência para o procedimento. Além disso, para procedimentos endoscópicos considerados de baixo risco de sangramento (por exemplo, colonoscopia diagnóstica para avaliar anemia ferropriva sem plano de polipectomia), a recomendação da ASGE é continuar os agentes durante o procedimento.
Se o adiamento da colonoscopia for considerado desaconselhável, o risco de tromboembolismo não for alto e o procedimento planejado for de alto risco de sangramento, a tienopiridina deve ser descontinuada 5 a 7 dias antes do procedimento. Mas se o risco de tromboembolismo for aumentado recomenda-se o uso de heparina de baixo peso molecular subcutânea como ponte durante os dias de suspensão das tienopiridinas, interrompendo 24 horas antes do exame.
Gerenciamento da Varfarina durante a colonoscopia
A varfarina é um agente anticoagulante comumente usado para o tratamento de uma variedade de distúrbios, incluindo trombose venosa profunda (TVP); embolia pulmonar; acidente vascular cerebral isquêmico; e profilaxia de tromboembolismo arterial de fibrilação atrial, flutter e distúrbios valvulares cardíacos.
É importante lembrar que, embora o objetivo de interromper os anticoagulantes periprocedimento seja reduzir o risco de sangramento, os pacientes que estão em terapia com varfarina ainda apresentam risco aumentado de sangramento pós-procedimento, apesar da retirada do medicamento antes do exame como recomendado.
Um estudo retrospectivo comparou o sangramento pós-polipectomia tardio em indivíduos que interromperam a varfarina com indivíduos que não estavam em uso de varfarina e encontrou taxas significativamente mais altas de sangramento naqueles que usaram varfarina apesar de ter sido retirada para os exames.
Semelhante às recomendações da ASGE para agentes antiplaquetários, a decisão de retirar ou continuar a varfarina durante a colonoscopia baseia-se na avaliação do risco de sangramento do procedimento planejado, o risco de tromboembolismo se a droga for suspensa e a urgência do procedimento. Se o procedimento for de baixo risco de sangramento (p. colonoscopia diagnóstica sem plano de polipectomia), a varfarina pode ser continuada durante o procedimento. Especificamente, a biópsia da mucosa é segura para ser realizada durante a colonoscopia para pacientes em uso de varfarina cuja razão normalizada internacional está na faixa terapêutica (RNI-alvo de 2,0 e 3,0).
No entanto, as diretrizes atuais recomendam que, para procedimentos de alto risco como a polipectomia, a varfarina deve ser interrompida 5 dias antes do exame. Quando é tomada a decisão de descontinuar a varfarina, o risco de tromboembolismo deve ser ponderado na decisão de fazer ou não ponte da varfarina com um anticoagulante de ação curta, como a heparina de baixo peso molecular. Para condições de alto risco de tromboembólico, deve-se considerar adiar o procedimento, principalmente se a duração do tratamento do anticoagulante pode ser alcançada em breve (por exemplo, 6 meses de varfarina para um TVP). Se o adiamento for considerado desaconselhável e o risco de tromboembolismo for alto, a varfarina deve ser descontinuada e iniciada a ponte com heparina de baixo peso molecular e retirada no dia anterior ao procedimento (ou seja, última dose 24 horas antes do procedimento).
Gerenciamento de anticoagulantes orais de ação direta durante a colonoscopia
Os anticoagulantes orais diretos (DOACs) são uma nova classe de anticoagulantes que inibem diretamente a trombina. Dabigatrana - (Pradaxa®) ou o fator Xa Rivaroxabana (Xarelto®), Apixabana (Eliquis®) e Edoxabana (Lixiana®) na cascata da coagulação.
As principais vantagens dos DOACs em relação à varfarina é que não necessitam de monitoramento com exames de sangue, menos interações com a dieta e outros medicamentos e início e eliminação mais rápidos da ação (com função renal normal).
Por outro lado, esses agentes são mais caros que a varfarina e, com a exceção da dabigatrana, não há meios disponíveis para reverter o efeito anticoagulante em caso de sangramento. Semelhante à varfarina, os DOACs aumentam o risco de sangramento de todas as causas. Não relacionado à polipectomia, a taxa de sangramento gastrointestinal (GI) foi maior para indivíduos tratados com dabigatrana (3% vs 2%), rivaroxabana (3,2% vs 2,2%) ou edoxabana (1,5% vs 1,2%) em comparação com indivíduos que tomam varfarina.
A razão para o risco aumento de sangramento GI com os DOACs não é claro. Nenhum estudo explorou especificamente taxas de sangramento com procedimentos endoscópicos de alto risco, como polipectomia; no entanto, um pequeno estudo japonês descobriu que a biópsia endoscópica da mucosa parece ser segura para pacientes em uso de dabigatrana.
As diretrizes mais recentes da ASGE (2016) incluíram recomendações sobre a gestão dos DOACs nos exames endoscópicos. Tal como acontece com outros agentes antiplaquetários e anticoagulantes, para procedimentos com baixo risco de sangramento, os DOACs provavelmente podem ser mantidos com segurança. Para procedimentos com alto risco de sangramento, como a polipectomia, os DOACs devem ser retirados antes do exame. Dado o rápido início e eliminação (com função renal normal) desses agentes, não há necessidade de ponte periprocedimento. As diretrizes recomendam manter esses agentes por 2 a 3 meias-vidas antes do procedimento (1 a 2 dias). Para pacientes com doença renal leve a moderada (clearance de creatinina <50 mL/min), o medicamento deve ser retirado 3 a 5 dias antes do procedimento. Geralmente, após o procedimento, o agente pode ser readministrado imediatamente ou dentro de vários dias, dependendo do risco de sangramento para a intervenção que foi realizada.
Quando readministrar as drogas anticoagulantes após o procedimento
Após tomar a decisão de descontinuar um antiplaquetário ou anticoagulante em preparação para um procedimento endoscópico, a próxima decisão importante é quando readministrar o medicamento após o procedimento. Infelizmente, as diretrizes não fornecem um consenso claro porque há muitos poucos estudos para basear as recomendações.
Para tienopiridinas, o ACC/ACG (diretrizes conjuntas do American College of Cardiology e American College of Gastroenterology) recomendam a readministração “assim que possível”, a ASGE recomenda o tempo com base na ponderação dos riscos de doença tromboembólica com a suspensão da medicação e os riscos de sangramento com base no procedimento realizado com readministração imediata, e a Sociedade Britânica de Gastroenterologia recomenda a readministração no dia seguinte ao procedimento. Todas essas recomendações são baseadas em opinião porque não há dados definitivos para orientar essas decisões.
Ao readministrar uma tienopiridina, outra questão controversa é se existe a necessidade de uma dose de ataque da droga (para obter níveis terapêuticos mais rápidos). Ao readministrar o clopidogrel em sua dose oral usual (75 mg ao dia), leva de 5 a 10 dias para atingir inibição plaquetária máxima, em comparação com 12 a 15 horas se o paciente receber 300 a 600 mg. A diretriz do JACC/ACG recomenda que a decisão quanto à necessidade da dose de ataque baseia-se no risco de doença tromboembólicos.
Para pacientes que estavam em uso de varfarina sem ponte, as diretrizes da ASGE recomendam a readministração da varfarina em 24 horas. Para os pacientes que estavam em varfarina que foi ponteada, a varfarina deve ser readministrada na noite do procedimento, enquanto a heparina deve ser retomada o mais rápido possível após o procedimento e retirada assim que o RNI se tornar terapêutico. No entanto, o ajuste dessas diretrizes deve ser caso a caso no cenário de procedimentos de alto risco de sangramento, como grandes polipectomias, porque mesmo a reintrodução da varfarina após 7 dias da polipectomia é fator de risco para sangramento pós-polipectomia tardio.
Para pacientes em uso de DOACs, a ASGE recomenda que esses agentes também sejam readministrados o mais rápido possível. Nos casos em que não podem ser readministrados dentro de 24 horas devido à preocupação com alto risco de sangramento, deve-se considerar a ponte com heparina para aqueles com alto risco tromboembólico.
Perfuração colorretal complicando a colonoscopia
Perfuração da colonoscopia
Como eu faço para tratar a perfuração pós-polipectomia?
Perfuração da colonoscopia
Como eu faço para tratar a perfuração pós-polipectomia?
Inegavelmente, a perfuração, embora rara, é a complicação mais preocupante e grave da colonoscopia diagnóstica ou terapêutica.
As perfurações geralmente ocorrem devido a um dos três mecanismos: (1) trauma mecânico causado pela pressão exercida pelo colonoscópio na parede do cólon (geralmente no segmento retossigmóide ou no reto durante a manobra de retroflexão do endoscópio em um reto pequeno) ou no local de uma estenose; (2) barotrauma por distensão excessiva do intestino (tipicamente o ceco); ou (3) de resultado direto de procedimentos terapêuticos como a mucosectomia.
Como esperado, a incidência de perfuração após colonoscopia terapêutica é nitidamente maior do que após colonoscopia diagnóstica, e o risco varia de acordo com o procedimento (Tabela 1). Após a polipectomia padrão com alça, uma perfuração se desenvolve com mais frequência quando os pólipos são >1 cm no cólon direito ou >2 cm no cólon esquerdo. A taxa de mortalidade associada à perfuração iatrogênica varia de 0 a 0,65%. Tem sido sugerido que uma incidência de perfuração superior a 1 em 500 colonoscopias ou superior a 1 em 1000 em colonoscopias de triagem deve levar a uma auditoria para revisão dos procedimentos.
As perfurações geralmente ocorrem devido a um dos três mecanismos: (1) trauma mecânico causado pela pressão exercida pelo colonoscópio na parede do cólon (geralmente no segmento retossigmóide ou no reto durante a manobra de retroflexão do endoscópio em um reto pequeno) ou no local de uma estenose; (2) barotrauma por distensão excessiva do intestino (tipicamente o ceco); ou (3) de resultado direto de procedimentos terapêuticos como a mucosectomia.
Como esperado, a incidência de perfuração após colonoscopia terapêutica é nitidamente maior do que após colonoscopia diagnóstica, e o risco varia de acordo com o procedimento (Tabela 1). Após a polipectomia padrão com alça, uma perfuração se desenvolve com mais frequência quando os pólipos são >1 cm no cólon direito ou >2 cm no cólon esquerdo. A taxa de mortalidade associada à perfuração iatrogênica varia de 0 a 0,65%. Tem sido sugerido que uma incidência de perfuração superior a 1 em 500 colonoscopias ou superior a 1 em 1000 em colonoscopias de triagem deve levar a uma auditoria para revisão dos procedimentos.
Devido ao mecanismo de lesão, trauma mecânico, as perfurações de uma colonoscopia diagnóstica são tipicamente grandes (> 2 cm) e localizadas no sigmoide. A lesão geralmente é produzida por trauma direto devido a uma introdução imprecisa do colonoscópio, movimentos do colonoscópio em direção à superfície da mucosa, manobras de retroflexão ou torção excessiva. Lesões indiretas também podem ocorrer como consequência do encurvamento ou alongamento da parte distal do cólon. A presença de divertículos em um cólon redundante ou aderências de cirurgias anteriores aumentam o risco de trauma mecânico durante a colonoscopia.
O barotrauma é produzido pela distensão excessiva do intestino devido à super insuflação, que produz lacerações lineares na parede do cólon que podem evoluir para defeitos de espessura total. Esse tipo de perfuração localiza-se mais frequentemente na região cecal, onde a camada muscular mais fina e o maior diâmetro do lúmen tornam essa região mais vulnerável a lesões por pressão.
Nas colonoscopias terapêuticas o mecanismo de perfuração pode ser o mesmo que ocorre durante a colonoscopia diagnóstica, ou pode ser devido à lesão térmica/elétrica da parede do cólon vista no momento ou manifestando-se como uma isquemia da parede, quando geralmente são menores. Neste último caso, a perfuração pode ocorrer com atraso de 24 a 72 h. O dano da parede pode ser incompleto e a perfuração oculta, pois é confinada pelos tecidos circundantes. Durante os dias ou semanas seguintes, pode desenvolver-se um abcesso que pode atrasar o diagnóstico.
A presença de aderências, doença diverticular grave, inflamação da mucosa, estenose, comorbidades, idade avançada, uso incorreto de corrente de corte ou coagulação, ressecção de pólipos com mais de 1 cm de tamanho localizados no cólon direito e experiência limitada do operador estão associados a um maior risco de perfuração em colonoscopias diagnósticas. A sedação profunda pode aumentar o risco de perfuração em comparação com sedação consciente, uma vez que se perde a resposta do paciente à dor, quando profundamente sedado.
Notavelmente, o emprego de técnicas avançadas de ressecção de mucosa (mucosectomia e dissecção de submucosa) aumentaram o risco de perfuração; no entanto, em nível populacional, o número desses procedimentos avançados como porcentagem de todas as polipectomias é pequeno.
Certas populações enfrentam maiores riscos de perfuração durante a colonoscopia, incluindo pacientes com diverticulose e doença inflamatória intestinal (DII). Pacientes com DII submetidos à colonoscopia pode ter um risco até 8 vezes maior de perfurações em comparação com pacientes sem DII. O uso de corticosteroides está associado a um risco 13 vezes maior de perfuração associada à colonoscopia.
Fatores de risco adicionais para perfuração incluem:
(1) A mobilidade reduzida do cólon que pode ser devido a aderências, divertículos, radioterapia, malignidade ou infecção.
(2) Anormalidades na mucosa podem ocorrer como resultado de doença inflamatória intestinal, malignidade, infecção, radioterapia, necrose ou ruptura parcial. Essas anormalidades podem causar fraqueza na parede do cólon e predispor à perfuração.
(3) Endoscopistas com baixo volume de exames apresentam taxas maiores de perfuração.
Principais etiologias da perfuração colonoscopia iatrogênica
Tipo de lesão
• Trauma mecânico direto
• Barotrauma
• Lesão térmica/elétrica
Procedimentos terapêuticos endoscópicos com risco de perfuração colonoscopia iatrogênica
• Stent colorretal
• Polipectomia
• Dilatação do cólon
• Coagulação por plasma de argônio (APC)
• Ressecção endoscópica da mucosa (EMR)
• Dissecção endoscópica da submucosa (ESD)
Prevenção da perfuração cólica durante a colonoscopia
Na colonoscopia diagnóstica ou de prevenção, a progressão do colonoscópio deve ser realizada de forma suave e cautelosa, e a formação de alça deve ser evitada ou minimizada. Quando ocorrer dor abdominal durante o exame, manobras alternativas (manobra auxiliar, compressão do abdome e mudança de decúbito) devem ser utilizadas e, quando se observa dificuldade objetiva de progressão, desistir é melhor do que infligir dano (grau de recomendação 1C).
Dificuldade incomum em atravessar o cólon sigmóide, exame difícil em paciente do sexo feminino ou idoso, ou a presença de doença diverticular ou obstrução colônica devem ser considerados condições alarmantes (grau de recomendação 1C).
O uso criterioso da insuflação de ar pode reduzir o risco de perfuração devido a um barotrauma, especialmente na presença de estenose visceral e em procedimentos mais demorados (grau de recomendação 1B).
Na retirada de pólipos (polipectomia), a alça de coagulação deve ser posicionada com precisão, promovendo o levantamento da mucosa do músculo subjacente da parede intestinal. Também é importante limitar a quantidade de tecido incluída na alça a um máximo de 2 cm, quando o pólipo for maior, recomenda-se fazer a técnica de fatiamento ou fragmentada (piecemeal) (grau de recomendação 1C).
Para a retirada de pólipos planos ou pouco elevados de qualquer tamanho, recomenda-se a retirada a frio (sem eletrocautério) em um fragmento ou em 2 ou mais fragmentos com ou sem a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa quando risco de perfurações se aproxima de zero (grau de recomendação 1C).
Para a retirada de pólipos sésseis maiores do que 10 mm, recomenda-se a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa reduzindo o risco de dano da eletrocoagulação na parede muscular (grau de recomendação 1C).
Atenção especial deve ser dada durante a remoção de pólipos no ceco, onde a parede fina pode predispor à perfuração, portanto, deve ser evitada o uso do eletrocautério (grau de recomendação 1C).
O uso do modo de corrente mista pode levar a danos nos tecidos muito menos profundos do que o modo de coagulação pura. Alguns estudos relataram um risco aumentado de perfuração durante a remoção de pequenos pólipos com uma pinça de biópsia quente (eletrocautério), enquanto um baixo risco está associado à polipectomia com alça fria (grau de recomendação 1C).
A dissecção endoscópica da submucosa (ESD) deve ser limitada a casos selecionados devido à alta taxa de complicações associadas (grau de recomendação 1C).
No que diz respeito ao tratamento com stent de estenose maligna, uma maior taxa de perfuração foi relatada em pacientes que receberam quimioterapia com bevacizumab. Portanto, a colocação de stent nesses pacientes deve ser desencorajada. Além disso, a dilatação de uma área estenótica antes ou após a colocação do stent não é aconselhável. Da mesma forma, a dilatação de massas tumorais ou segmentos inflamados ativamente em pacientes com doença de Crohn deve ser evitada.
Finalmente, a experiência limitada do médico colonoscopista, ou seja, durante a curva de aprendizado, está associada a um risco aumentado de perfuração durante os exames diagnósticos e terapêuticos.
Se a perfuração cólica for detectada durante o procedimento pelo endoscopista, uma descrição detalhada deve ser fornecida incluindo as seguintes informações:
Diagnóstico da perfuração cólica durante a colonoscopia
O local mais comum de perfuração é o cólon sigmóide (53-65 %), seguido pelo ceco, cólon ascendente, cólon transverso, cólon descendente e reto.
O barotrauma é produzido pela distensão excessiva do intestino devido à super insuflação, que produz lacerações lineares na parede do cólon que podem evoluir para defeitos de espessura total. Esse tipo de perfuração localiza-se mais frequentemente na região cecal, onde a camada muscular mais fina e o maior diâmetro do lúmen tornam essa região mais vulnerável a lesões por pressão.
Nas colonoscopias terapêuticas o mecanismo de perfuração pode ser o mesmo que ocorre durante a colonoscopia diagnóstica, ou pode ser devido à lesão térmica/elétrica da parede do cólon vista no momento ou manifestando-se como uma isquemia da parede, quando geralmente são menores. Neste último caso, a perfuração pode ocorrer com atraso de 24 a 72 h. O dano da parede pode ser incompleto e a perfuração oculta, pois é confinada pelos tecidos circundantes. Durante os dias ou semanas seguintes, pode desenvolver-se um abcesso que pode atrasar o diagnóstico.
A presença de aderências, doença diverticular grave, inflamação da mucosa, estenose, comorbidades, idade avançada, uso incorreto de corrente de corte ou coagulação, ressecção de pólipos com mais de 1 cm de tamanho localizados no cólon direito e experiência limitada do operador estão associados a um maior risco de perfuração em colonoscopias diagnósticas. A sedação profunda pode aumentar o risco de perfuração em comparação com sedação consciente, uma vez que se perde a resposta do paciente à dor, quando profundamente sedado.
Notavelmente, o emprego de técnicas avançadas de ressecção de mucosa (mucosectomia e dissecção de submucosa) aumentaram o risco de perfuração; no entanto, em nível populacional, o número desses procedimentos avançados como porcentagem de todas as polipectomias é pequeno.
Certas populações enfrentam maiores riscos de perfuração durante a colonoscopia, incluindo pacientes com diverticulose e doença inflamatória intestinal (DII). Pacientes com DII submetidos à colonoscopia pode ter um risco até 8 vezes maior de perfurações em comparação com pacientes sem DII. O uso de corticosteroides está associado a um risco 13 vezes maior de perfuração associada à colonoscopia.
Fatores de risco adicionais para perfuração incluem:
(1) A mobilidade reduzida do cólon que pode ser devido a aderências, divertículos, radioterapia, malignidade ou infecção.
(2) Anormalidades na mucosa podem ocorrer como resultado de doença inflamatória intestinal, malignidade, infecção, radioterapia, necrose ou ruptura parcial. Essas anormalidades podem causar fraqueza na parede do cólon e predispor à perfuração.
(3) Endoscopistas com baixo volume de exames apresentam taxas maiores de perfuração.
Principais etiologias da perfuração colonoscopia iatrogênica
Tipo de lesão
• Trauma mecânico direto
• Barotrauma
• Lesão térmica/elétrica
Procedimentos terapêuticos endoscópicos com risco de perfuração colonoscopia iatrogênica
• Stent colorretal
• Polipectomia
• Dilatação do cólon
• Coagulação por plasma de argônio (APC)
• Ressecção endoscópica da mucosa (EMR)
• Dissecção endoscópica da submucosa (ESD)
Prevenção da perfuração cólica durante a colonoscopia
Na colonoscopia diagnóstica ou de prevenção, a progressão do colonoscópio deve ser realizada de forma suave e cautelosa, e a formação de alça deve ser evitada ou minimizada. Quando ocorrer dor abdominal durante o exame, manobras alternativas (manobra auxiliar, compressão do abdome e mudança de decúbito) devem ser utilizadas e, quando se observa dificuldade objetiva de progressão, desistir é melhor do que infligir dano (grau de recomendação 1C).
Dificuldade incomum em atravessar o cólon sigmóide, exame difícil em paciente do sexo feminino ou idoso, ou a presença de doença diverticular ou obstrução colônica devem ser considerados condições alarmantes (grau de recomendação 1C).
O uso criterioso da insuflação de ar pode reduzir o risco de perfuração devido a um barotrauma, especialmente na presença de estenose visceral e em procedimentos mais demorados (grau de recomendação 1B).
Na retirada de pólipos (polipectomia), a alça de coagulação deve ser posicionada com precisão, promovendo o levantamento da mucosa do músculo subjacente da parede intestinal. Também é importante limitar a quantidade de tecido incluída na alça a um máximo de 2 cm, quando o pólipo for maior, recomenda-se fazer a técnica de fatiamento ou fragmentada (piecemeal) (grau de recomendação 1C).
Para a retirada de pólipos planos ou pouco elevados de qualquer tamanho, recomenda-se a retirada a frio (sem eletrocautério) em um fragmento ou em 2 ou mais fragmentos com ou sem a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa quando risco de perfurações se aproxima de zero (grau de recomendação 1C).
Para a retirada de pólipos sésseis maiores do que 10 mm, recomenda-se a injeção na submucosa de solução salina para criar uma almofada de líquido que separa as camadas mucosa-submucosa reduzindo o risco de dano da eletrocoagulação na parede muscular (grau de recomendação 1C).
Atenção especial deve ser dada durante a remoção de pólipos no ceco, onde a parede fina pode predispor à perfuração, portanto, deve ser evitada o uso do eletrocautério (grau de recomendação 1C).
O uso do modo de corrente mista pode levar a danos nos tecidos muito menos profundos do que o modo de coagulação pura. Alguns estudos relataram um risco aumentado de perfuração durante a remoção de pequenos pólipos com uma pinça de biópsia quente (eletrocautério), enquanto um baixo risco está associado à polipectomia com alça fria (grau de recomendação 1C).
A dissecção endoscópica da submucosa (ESD) deve ser limitada a casos selecionados devido à alta taxa de complicações associadas (grau de recomendação 1C).
No que diz respeito ao tratamento com stent de estenose maligna, uma maior taxa de perfuração foi relatada em pacientes que receberam quimioterapia com bevacizumab. Portanto, a colocação de stent nesses pacientes deve ser desencorajada. Além disso, a dilatação de uma área estenótica antes ou após a colocação do stent não é aconselhável. Da mesma forma, a dilatação de massas tumorais ou segmentos inflamados ativamente em pacientes com doença de Crohn deve ser evitada.
Finalmente, a experiência limitada do médico colonoscopista, ou seja, durante a curva de aprendizado, está associada a um risco aumentado de perfuração durante os exames diagnósticos e terapêuticos.
Se a perfuração cólica for detectada durante o procedimento pelo endoscopista, uma descrição detalhada deve ser fornecida incluindo as seguintes informações:
- Indicação de colonoscopia (ou seja, diagnóstica ou terapêutica).
- Patologia colônica associada (por exemplo, estenoses, pólipos, tumores).
- Administração de sedação, analgesia ou anestesia para a colonoscopia.
- Estado geral do paciente e presença de comorbidades.
- Tipo de gás usado para insuflação.
- Qualidade da preparação do cólon.
- Hora da ocorrência da perfuração.
- Causa mais provável para a perfuração (por exemplo, lesão térmica, lesão mecânica).
- Localização e tamanho da lesão.
- Se um tratamento endoscópico foi tentado ou concluído.
- Como foi realizado o reparo endoscópico.
- Presença de distensão abdominal aumentando a probabilidade de síndrome compartimental abdominal.
Diagnóstico da perfuração cólica durante a colonoscopia
O local mais comum de perfuração é o cólon sigmóide (53-65 %), seguido pelo ceco, cólon ascendente, cólon transverso, cólon descendente e reto.
Aproximadamente 45-60% das perfurações são detectadas pelo endoscopista durante a realização da colonoscopia, embora um número considerável não seja reconhecido imediatamente, mas sim suspeitada com base nos sinais e sintomas clínicos ocorridos após o procedimento endoscópico.
Geralmente, a perfuração ocorre durante o exame ou nas primeiras 24 horas após o procedimento devido a progressão da lesão térmica ou isquêmica. O diagnóstico precoce é fundamental para o tratamento e prognóstico. Durante a colonoscopia, o diagnóstico geralmente é realizado pela visão direta do defeito da parede ou pela visualização dos tecidos intra-abdominais através da parede do cólon ou, após a ressecção, pelo chamado sinal do alvo, ou seja, evidência de secção da camada muscular sobre a lesão ressecada.
Um atraso no diagnóstico da perfuração é uma questão crítica para os resultados do tratamento; quando o diagnóstico demora mais de 24 h, aumenta a chance de que tratamentos mais invasivos (por exemplo, cirurgia) sejam necessários. Para uma perfuração intestinal não vista durante a colonoscopia, o diagnóstico é baseado em achados clínicos, laboratoriais e radiológicos.
A apresentação clínica de uma perfuração pode variar amplamente, dependendo do tamanho da perfuração, do tipo de agente etiológico, da localização no cólon, do grau de contaminação intraperitoneal e do estado geral do paciente. Na maioria dos pacientes (91-92%), os sintomas se desenvolvem nas primeiras 48 horas após a conclusão da colonoscopia. O sintoma mais comum é a dor abdominal associada à distensão, embora tenham sido descritos casos indolores ou casos com dor tipo cãibra intensa.
Outros sintomas encontrados com frequência incluem a sensibilidade abdominal descompressiva em defesa/rebote (82,5) com peritonite difusa, taquicardia (62,5%), leucocitose (40%), febre (38%), sangramento retal (15%) e distensão abdominal isolada (6,6%). Apenas um pequeno número de pacientes com perfuração (5%) permaneceu assintomático.
Cenários clínicos semelhantes a peritonite também podem ocorrer na ausência de perfuração. Por exemplo, uma lesão térmica transmural após polipectomia com irritação serosa sem qualquer perfuração óbvia produz peritonite localizada que é passível de tratamento não cirúrgico. Assim, exames bioquímicos e de imagem estão sempre indicados quando há suspeita de perfuração na colonoscopia.
Exames laboratoriais devem ser realizados para marcadores inflamatórios que podem revelar infecções bacterianas graves associadas à perfuração, como contagem de glóbulos brancos (WBC) e proteína C reativa (PCR). Em caso de apresentação tardia (> 12 h), o nível de pró-calcitonina (PCT) pode ser útil para o diagnóstico.
A perfuração intraperitoneal leva ao extravasamento de ar e conteúdo cólico para a cavidade abdominal. Em caso de suspeita, radiografias simples de tórax e abdome podem demonstrar ar livre, embora a TC (tomografia computadorizada) seja superior a uma radiografia de tórax em posição vertical (posição de pé). Se a suspeita clínica persistir após uma radiografia simples normal, uma tomografia computadorizada (TC) de abdome com realce de contraste deve ser solicitada, pois essa ferramenta de imagem pode detectar facilmente pequenas quantidades de ar e líquidos intraperitoneais livres, em alguns casos com os focos do gás reunidos perto do local da perfuração.
Deve-se suspeitar de perfuração tardia quando ocorrer dor abdominal, distensão abdominal, sinais de peritonite localizada ou difusa, febre e/ou leucocitose após o procedimento. O aparecimento de peritonite generalizada, sepse e instabilidade hemodinâmica representam fatores prognósticos negativos, exigindo cirurgia de urgência. O tratamento cirúrgico convencional de complicações perfurantes está associado a uma morbidade relativamente alta (entre 5 e 30%) e mortalidade.
Raramente, a perfuração cólica é extraperitoneal, levando à passagem de ar para o espaço retroperitoneal, que pode então se difundir ao longo dos planos fasciais e grandes vasos, causando pneumoretroperitônio, pneumomediastino, pneumopericárdio, pneumotórax e enfisema subcutâneo. Esses pacientes podem ter uma apresentação atípica, incluindo crepitação subcutânea, edema no pescoço, dor torácica e falta de ar após a colonoscopia.
As recomendações a seguir foram desenvolvidas usando uma grande série clínica e opiniões de especialistas, uma vez que faltam estudos randomizados sobre esse tema.
Representação das relações peritoneal e mesentérica em vários níveis do cólon e do reto
Geralmente, a perfuração ocorre durante o exame ou nas primeiras 24 horas após o procedimento devido a progressão da lesão térmica ou isquêmica. O diagnóstico precoce é fundamental para o tratamento e prognóstico. Durante a colonoscopia, o diagnóstico geralmente é realizado pela visão direta do defeito da parede ou pela visualização dos tecidos intra-abdominais através da parede do cólon ou, após a ressecção, pelo chamado sinal do alvo, ou seja, evidência de secção da camada muscular sobre a lesão ressecada.
Um atraso no diagnóstico da perfuração é uma questão crítica para os resultados do tratamento; quando o diagnóstico demora mais de 24 h, aumenta a chance de que tratamentos mais invasivos (por exemplo, cirurgia) sejam necessários. Para uma perfuração intestinal não vista durante a colonoscopia, o diagnóstico é baseado em achados clínicos, laboratoriais e radiológicos.
A apresentação clínica de uma perfuração pode variar amplamente, dependendo do tamanho da perfuração, do tipo de agente etiológico, da localização no cólon, do grau de contaminação intraperitoneal e do estado geral do paciente. Na maioria dos pacientes (91-92%), os sintomas se desenvolvem nas primeiras 48 horas após a conclusão da colonoscopia. O sintoma mais comum é a dor abdominal associada à distensão, embora tenham sido descritos casos indolores ou casos com dor tipo cãibra intensa.
Outros sintomas encontrados com frequência incluem a sensibilidade abdominal descompressiva em defesa/rebote (82,5) com peritonite difusa, taquicardia (62,5%), leucocitose (40%), febre (38%), sangramento retal (15%) e distensão abdominal isolada (6,6%). Apenas um pequeno número de pacientes com perfuração (5%) permaneceu assintomático.
Cenários clínicos semelhantes a peritonite também podem ocorrer na ausência de perfuração. Por exemplo, uma lesão térmica transmural após polipectomia com irritação serosa sem qualquer perfuração óbvia produz peritonite localizada que é passível de tratamento não cirúrgico. Assim, exames bioquímicos e de imagem estão sempre indicados quando há suspeita de perfuração na colonoscopia.
Exames laboratoriais devem ser realizados para marcadores inflamatórios que podem revelar infecções bacterianas graves associadas à perfuração, como contagem de glóbulos brancos (WBC) e proteína C reativa (PCR). Em caso de apresentação tardia (> 12 h), o nível de pró-calcitonina (PCT) pode ser útil para o diagnóstico.
A perfuração intraperitoneal leva ao extravasamento de ar e conteúdo cólico para a cavidade abdominal. Em caso de suspeita, radiografias simples de tórax e abdome podem demonstrar ar livre, embora a TC (tomografia computadorizada) seja superior a uma radiografia de tórax em posição vertical (posição de pé). Se a suspeita clínica persistir após uma radiografia simples normal, uma tomografia computadorizada (TC) de abdome com realce de contraste deve ser solicitada, pois essa ferramenta de imagem pode detectar facilmente pequenas quantidades de ar e líquidos intraperitoneais livres, em alguns casos com os focos do gás reunidos perto do local da perfuração.
Deve-se suspeitar de perfuração tardia quando ocorrer dor abdominal, distensão abdominal, sinais de peritonite localizada ou difusa, febre e/ou leucocitose após o procedimento. O aparecimento de peritonite generalizada, sepse e instabilidade hemodinâmica representam fatores prognósticos negativos, exigindo cirurgia de urgência. O tratamento cirúrgico convencional de complicações perfurantes está associado a uma morbidade relativamente alta (entre 5 e 30%) e mortalidade.
Raramente, a perfuração cólica é extraperitoneal, levando à passagem de ar para o espaço retroperitoneal, que pode então se difundir ao longo dos planos fasciais e grandes vasos, causando pneumoretroperitônio, pneumomediastino, pneumopericárdio, pneumotórax e enfisema subcutâneo. Esses pacientes podem ter uma apresentação atípica, incluindo crepitação subcutânea, edema no pescoço, dor torácica e falta de ar após a colonoscopia.
As recomendações a seguir foram desenvolvidas usando uma grande série clínica e opiniões de especialistas, uma vez que faltam estudos randomizados sobre esse tema.
- Após colonoscopias diagnósticas ou terapêuticas, todos os pacientes que apresentarem dor e/ou sensibilidade abdominal e/ou distensão abdominal e/ou febre e/ou sangramento retal devem ser investigados para perfuração por exames laboratoriais e de imagem (Recomendação Grau 1B).
- Os marcadores bioquímicos mínimos que devem ser solicitados em caso de suspeita de perfuração são hemograma/leucograma e proteína C reativa (grau de recomendação 1C).
- A perfuração deve ser confirmada com a demonstração de ar livre intra ou extraperitoneal (Recomendação 1B). A tomografia computadorizada é mais sensível do que as radiografias abdominais padrão para detectar ar livre (grau de recomendação 1C).
- No caso de sinais peritoneais localizados, a tomografia computadorizada com contraste venoso e retal pode ser uma ferramenta auxiliar útil para confirmar a viabilidade do manejo não cirúrgico da perfuração (grau de recomendação 1C).
Representação das relações peritoneal e mesentérica em vários níveis do cólon e do reto
O cólon transverso e sigmóide estão localizados intraperitonealmente; nesses níveis, o peritônio visceral forma uma cobertura completa sobre o exterior do intestino (a serosa), que é contínuo com o mesentério (mesocólon transverso e sigmóide). Em contraste, o cólon ascendente e descendente se encontra dentro da cavidade peritoneal lateral, com sua superfície posterior e lateral estrão no retroperitônio. Nesses níveis, o peritônio visceral está presente apenas anteriormente e medialmente; não há verdadeiro mesentério, já que o mesentério em desenvolvimento se fundiu ao peritônio parietal posterior. A porção superior do reto está acima da reflexão peritoneal e a superfície anterior é coberta por peritônio que forma a bolsa retovesical em homens e a bolsa retouterina em mulheres, mas não existe serosa na sua superfície posterior.
Tratamento da perfuração colônica durante a colonoscopia
Uma vez que o diagnóstico de perfuração seja confirmado durante o exame ou tardiamente por exames clínicos e radiológicos, a decisão entre os tratamentos cirúrgico e não cirúrgico dependerá do tipo de lesão, da qualidade do preparo intestinal, da patologia colônica subjacente e da estabilidade clínica do paciente. No entanto, uma consulta com a cirurgia deve ser obtida em todos os casos de perfuração.
Sempre que houver suspeita de grande perfuração com o paciente apresentando sinais e sintomas de peritonite, a abordagem cirúrgica de emergência é razoável, recomendada e segura. O manejo cirúrgico também é recomendado em pacientes com doenças colônicas concomitantes que requerem cirurgia, pacientes transplantados e pacientes imunossuprimidos. Em pacientes selecionados com dor localizada, ar livre sem líquido livre difuso os exames de imagem, estabilidade hemodinâmica e ausência de febre, o manejo não cirúrgico (conservador) pode ser apropriado e está associada a baixa morbidade, baixa mortalidade e curta permanência hospitalar. O manejo conservador geralmente é adequado para pequenas perfurações bloqueadas que ocorreram durante uma colonoscopia terapêutica (polipectomia) em pacientes com uma preparação intestinal ideal.
O tratamento conservador consiste em monitoramento clínico e de imagem a cada 3-6 h, repouso intestinal absoluto (jejum), líquidos intravenosos para hidratação, administração intravenosa de antibióticos de amplo espectro e acompanhamento de equipe multidisciplinar para detectar prontamente o desenvolvimento de sepse e sinais de peritonite. A drenagem do ar peritoneal através de uma punção com agulha de Veress pode ser útil para aliviar a dor abdominal, melhorar a função respiratória e facilitar o fechamento do local da perfuração. A taxa geral de sucesso dos tratamentos conservadores para perfuração colônica varia de 33 a 90%.
Um sucesso inicial e precoce com o tratamento não cirúrgico não exclui a necessidade posterior de cirurgia. Se o tratamento conservador for bem-sucedido, a melhora clínica ocorrerá gradativamente em 24 horas, mas recomenda-se um acompanhamento clínico e bioquímico contínuo e rigoroso. Em casos de deterioração clínica ou progressão para quadro séptico ou peritonite, o tratamento cirúrgico não deve ser adiado. Apenas a presença de ar livre abaixo do diafragma não constitui indicação absoluta de cirurgia de urgência.
É importante notar que as taxas de complicações e o tempo de internação hospitalar são significativamente maiores em pacientes que foram submetidos à cirurgia após tratamento conservador do que em pacientes que foram inicialmente tratados com cirurgia. De fato, quando o tratamento cirúrgico é retardado, a peritonite e a inflamação da parede do cólon podem piorar, exigindo uma cirurgia mais invasiva que está associada a um pior prognóstico. Idealmente, a decisão de prosseguir com a cirurgia deve ser tomada o mais cedo possível após a colonoscopia.
O tratamento endoscópico é possível quando o local da perfuração é reconhecido durante o exame ou dentro de 4 horas após o procedimento e o preparo intestinal ainda é adequado. A terapia endoscópica urgente com colocação de endoclipe é valiosa, com altas taxas de sucesso e pode evitar a necessidade de cirurgia. A decisão de realizar o fechamento endoscópico da perfuração colônica depende do tamanho e da causa da lesão colônica, bem como da experiência do endoscopista e da disponibilidade de dispositivos endoscópicos apropriado.
O fechamento da perfuração com clipe endoscópico é recomendado para pequenas perfurações (menos de 1 cm) originadas de colonoscopias diagnósticas ou terapêuticas, com uma taxa de sucesso de 59-100%. Há poucos relatos na literatura sobre fechamento com clipes convencionais para perfurações maiores que 1 cm. Uma limitação do fechamento endoscópico é a dificuldade de avaliar a completude do fechamento colônico após a aplicação do clipe. Isso pode resultar em complicações tardias, como abscessos intra-abdominais devido a um vazamento intermitente.
Tratamento da perfuração colônica durante a colonoscopia
Uma vez que o diagnóstico de perfuração seja confirmado durante o exame ou tardiamente por exames clínicos e radiológicos, a decisão entre os tratamentos cirúrgico e não cirúrgico dependerá do tipo de lesão, da qualidade do preparo intestinal, da patologia colônica subjacente e da estabilidade clínica do paciente. No entanto, uma consulta com a cirurgia deve ser obtida em todos os casos de perfuração.
Sempre que houver suspeita de grande perfuração com o paciente apresentando sinais e sintomas de peritonite, a abordagem cirúrgica de emergência é razoável, recomendada e segura. O manejo cirúrgico também é recomendado em pacientes com doenças colônicas concomitantes que requerem cirurgia, pacientes transplantados e pacientes imunossuprimidos. Em pacientes selecionados com dor localizada, ar livre sem líquido livre difuso os exames de imagem, estabilidade hemodinâmica e ausência de febre, o manejo não cirúrgico (conservador) pode ser apropriado e está associada a baixa morbidade, baixa mortalidade e curta permanência hospitalar. O manejo conservador geralmente é adequado para pequenas perfurações bloqueadas que ocorreram durante uma colonoscopia terapêutica (polipectomia) em pacientes com uma preparação intestinal ideal.
O tratamento conservador consiste em monitoramento clínico e de imagem a cada 3-6 h, repouso intestinal absoluto (jejum), líquidos intravenosos para hidratação, administração intravenosa de antibióticos de amplo espectro e acompanhamento de equipe multidisciplinar para detectar prontamente o desenvolvimento de sepse e sinais de peritonite. A drenagem do ar peritoneal através de uma punção com agulha de Veress pode ser útil para aliviar a dor abdominal, melhorar a função respiratória e facilitar o fechamento do local da perfuração. A taxa geral de sucesso dos tratamentos conservadores para perfuração colônica varia de 33 a 90%.
Um sucesso inicial e precoce com o tratamento não cirúrgico não exclui a necessidade posterior de cirurgia. Se o tratamento conservador for bem-sucedido, a melhora clínica ocorrerá gradativamente em 24 horas, mas recomenda-se um acompanhamento clínico e bioquímico contínuo e rigoroso. Em casos de deterioração clínica ou progressão para quadro séptico ou peritonite, o tratamento cirúrgico não deve ser adiado. Apenas a presença de ar livre abaixo do diafragma não constitui indicação absoluta de cirurgia de urgência.
É importante notar que as taxas de complicações e o tempo de internação hospitalar são significativamente maiores em pacientes que foram submetidos à cirurgia após tratamento conservador do que em pacientes que foram inicialmente tratados com cirurgia. De fato, quando o tratamento cirúrgico é retardado, a peritonite e a inflamação da parede do cólon podem piorar, exigindo uma cirurgia mais invasiva que está associada a um pior prognóstico. Idealmente, a decisão de prosseguir com a cirurgia deve ser tomada o mais cedo possível após a colonoscopia.
O tratamento endoscópico é possível quando o local da perfuração é reconhecido durante o exame ou dentro de 4 horas após o procedimento e o preparo intestinal ainda é adequado. A terapia endoscópica urgente com colocação de endoclipe é valiosa, com altas taxas de sucesso e pode evitar a necessidade de cirurgia. A decisão de realizar o fechamento endoscópico da perfuração colônica depende do tamanho e da causa da lesão colônica, bem como da experiência do endoscopista e da disponibilidade de dispositivos endoscópicos apropriado.
O fechamento da perfuração com clipe endoscópico é recomendado para pequenas perfurações (menos de 1 cm) originadas de colonoscopias diagnósticas ou terapêuticas, com uma taxa de sucesso de 59-100%. Há poucos relatos na literatura sobre fechamento com clipes convencionais para perfurações maiores que 1 cm. Uma limitação do fechamento endoscópico é a dificuldade de avaliar a completude do fechamento colônico após a aplicação do clipe. Isso pode resultar em complicações tardias, como abscessos intra-abdominais devido a um vazamento intermitente.
Quando o endoscopista não consegue fechar a perfuração com os endoclipes por motivos diversos ou não está seguro do seu fechamento completo, a cirurgia deve ser realizada o mais rapidamente possível.
Após um fechamento endoscópico bem-sucedido, é aconselhável que a cirurgia acompanhe o paciente juntamente com o endoscopista. O tratamento endoscópico é continuado com o jejum, antibioticoterapia de amplo espectro e hidratação intravenosa. A observação cuidadosa dos sinais de irritação peritoneal e o monitoramento dos parâmetros inflamatórios bioquímicos (PCR e leucograma) são cruciais. Quando a dor desaparece e os parâmetros inflamatórios e a função intestinal normalizam, a dieta oral pode ser retomada. A duração da observação é subjetiva, mas obviamente relacionada ao estado do paciente e à resposta ao tratamento conservador (não cirúrgico) ou endoscópico. A duração média da permanência hospitalar após o manejo não cirúrgico da perfuração varia de 9 a 13 dias.
Uma dieta líquida pode começar dentro de 1 a 2 dias após o início do manejo conservador da perfuração, de acordo com o estado clínico do paciente (Grau de Recomendação 1C).
Uma dieta líquida pode ser iniciada imediatamente após o reparo endoscópico da perfuração, de acordo com o estado clínico do paciente (Grau de recomendação 1C).
O paciente tratado para perfuração deve ser monitorado clinicamente, por exames laboratoriais e exames de imagem. Clinicamente, sinais peritoneais, como dor abdominal, sensibilidade rebote e proteção muscular, bem como sinais de infecção, como febre, náusea, vômito, distensão abdominal e diarreia, devem ser registrados. A avaliação frequente do estado físico e dos sinais vitais deve ser completada por exames laboratoriais para leucócitos, PCR, Hb, ureia e eletrólitos. A tomografia computadorizada continua sendo a ferramenta mais precisa a ser realizada em caso de deterioração clínica, principalmente quando a necessidade de cirurgia está em questão e pode ser realizada antes da alta hospitalar para confirmar a resolução com o tratamento não cirúrgico ou cirúrgico.
Qual é o tipo e a duração recomendados da antibioticoterapia em pacientes submetidos a fechamento endoscópico bem-sucedido ou tratamento conservador da perfuração?
Em pacientes submetidos ao reparo endoscópico da perfuração, o controle da infecção geralmente é obtido com um curso de antibioticoterapia venosa de curto prazo (3 a 5 dias). Os antibióticos devem ser interrompidos se não houver sinais de inflamação sistêmica e/ou peritonite.
Considerando a composição da microbiota intestinal no intestino grosso, pacientes com perfuração colônica necessitam de cobertura antimicrobiana para bactérias gram-negativas e anaeróbias. Os organismos potencialmente infectantes em procedimentos colorretais são derivados do lúmen intestinal, Bacteroides fragilis e outros anaeróbios, bem como Enterobacteriaceae, como Escherichia coli, são as bactérias mais comuns.
Se houver qualquer sinal de um processo infeccioso em andamento, os antibióticos devem ser continuados. Uma TC abdominal é recomendada após 5 a 7 dias para excluir sinais residuais de peritonite ou formação de abscesso e para excluir a possível necessidade de intervenção cirúrgica.
Qual é o tipo e a duração recomendados da profilaxia antitrombótica em pacientes submetidos a fechamento endoscópico bem-sucedido ou tratamento conservador da perfuração?
A sepse está associada à ativação da coagulação sanguínea (hipercoagulabilidade) contribuindo para o tromboembolismo venoso (TEV). Pacientes com sepse abdominal podem apresentar risco aumentado de TEV devido às suas condições pré-mórbidas, intervenção cirúrgica, admissão de diagnóstico de sepse e eventos e exposições como cateterismo venoso central, exames e procedimentos invasivos e drogas que potencializam a imobilidade.
Em pacientes com PIC submetidos a procedimento cirúrgico, a tromboprofilaxia geralmente é recomendada durante a internação e posteriormente de acordo com a doença de base e comorbidades (Grau de Recomendação 1B).
Tratamento cirúrgico da perfuração colônica durante a colonoscopia
A cirurgia laparoscópica (laparoscopia exploradora) é mandatória no tratamento de pacientes com sinais de peritonite difusa e sepse, grandes perfurações, falha do tratamento conservador e na presença de algumas patologias concomitantes, como câncer colorretal ou pólipos não ressecados com alta suspeita de carcinoma.
A morbimortalidade perioperatória relacionada à cirurgia para perfuração colônica é considerável, com taxas de 21–44% e 7–25%, respectivamente. Pacientes particularmente frágeis, como idosos e com baixa pressão arterial pré-operatória (choque), têm maiores riscos de mortalidade. Assim, a seleção adequada de pacientes e procedimentos cirúrgicos são cruciais para limitar a morbimortalidade relacionada à cirurgia para perfuração colônica durante a colonoscopia.
Em geral, os achados intraoperatórios determinam a melhor técnica a ser aplicada de acordo com os diferentes cenários. Os procedimentos cirúrgicos incluem sutura da perfuração, ressecção em cunha, colostomia por exteriorização da perfuração e ressecção colônica com ou sem anastomose primária ou colostomia. A decisão quanto ao tipo de procedimento cirúrgico depende (a) do tamanho, localização e etiologia da perfuração; (b) a viabilidade do cólon e mesocólon circundantes; (c) o grau e o tempo de desenvolvimento da peritonite; (d) estado geral do paciente e presença de comorbidades; (e) a qualidade da preparação colônica; e (f) a presença de lesões residuais não ressecadas durante o procedimento de colonoscopia.
A decisão de qual procedimento realizar, portanto, depende de muitas variáveis, e deve ser feita após uma inspeção cuidadosa de todo o cólon e da cavidade abdominal. A laparoscopia permite visualizar o defeito na parede do cólon, seu tamanho e localização, principais fatores que influenciam a escolha do tratamento.
Se nenhuma lesão que exigiria ressecção cirúrgica for observada durante a colonoscopia, o tamanho da perfuração for pequeno e o cólon estiver saudável e bem perfundido, então um reparo primário laparoscópico pode ser realizado com segurança. Além disso, a exploração laparoscópica permite a aspiração e irrigação da cavidade peritoneal incluindo a coleta de material para cultura.
Para resumir, a laparoscopia exploratória é indicada para fins diagnósticos e terapêuticos, e dependendo da habilidade do cirurgião, existe potencial para procedimentos cirúrgicos definitivos, incluindo sutura do defeito, ressecção em cunha e ressecção segmentar com ou sem anastomose e/ou ostomia.
A laparoscopia exploratória tem uma morbidade e mortalidade significativamente menor em comparação com a laparotomia exploradora no cenário de emergência. A conversão de laparoscopia para laparotomia deve ser considerada sempre que necessário em relação à capacidade do operador de proceder laparoscopicamente, à viabilidade do tecido e ao estado do paciente (grau de recomendação 1C).
Recomendações:
No caso de câncer de cólon perfurado, a cirurgia deve seguir os princípios oncológicos da ressecção do câncer.
O controle de danos é uma técnica cirúrgica originalmente utilizada na cirurgia do trauma que consiste em três etapas: (1) uma laparotomia inicial abreviada com o objetivo de controlar a hemorragia e a contaminação com fechamento abdominal temporário (TAC); (2) ressuscitação até a melhora da fisiologia; e (3) retornar à sala de cirurgia após 24–72 h para reparo definitivo da lesão e fechamento da parede abdominal.
A perfuração não tratada ou mal diagnosticada quase sempre progride para peritonite e sepse, resultando em morbidade grave e prognóstico muito ruim. Notavelmente, taxas de morbidade de até 43% e taxas de mortalidade de até 25% foram relatadas. Quase um quarto dos pacientes receberá um diagnóstico tardio, com incidência de 45% de peritonite fecal. O processo inflamatório resultante associado à peritonite limita claramente as opções operatórias, impossibilitando um procedimento de estágio único e resultando em desvio fecal (colostomia) em 38% dos pacientes com peritonite fecal. Vários estudos relataram que idade > 67 anos, escore ASA, lesões contusas, mau preparo intestinal e esteroides são fatores de risco para aumento da morbidade pós-operatória.
Acompanhamento após o tratamento com sucesso da perfuração cólica durante a colonoscopia
Existe alguma recomendação para realizar uma endoscopia de vigilância após o sucesso do tratamento da perfuração? Se houver, qual o tempo recomendado para isso?
Atualmente, não há estudos na literatura com foco nas indicações e no momento da endoscopia de vigilância após o tratamento bem-sucedido da perfuração. No entanto, com base nas evidências disponíveis e na experiência clínica, uma colonoscopia de vigilância pode ser realizada com base na indicação inicial (p. e considerando a relação risco-benefício da realização de um exame endoscópico.
Assim, em casos de perfuração durante uma colonoscopia cirúrgica (por exemplo, polipectomia, ressecção endoscópica da mucosa ou dissecção endoscópica da submucosa), uma colonoscopia de vigilância deve ser realizada de acordo com as diretrizes atuais para determinar se a ressecção durante a endoscopia primária foi completa.
A colonoscopia é especificamente contraindicada em casos de perfuração conhecida ou suspeita. Consequentemente, qualquer colonoscopia após o tratamento da perfuração deve ser realizada uma vez que a parede do cólon esteja completamente curada. Supondo que o tempo de cicatrização após o tratamento da perfuração seja comparável ao após suturas cirúrgicas ou anastomose, uma colonoscopia de vigilância pode ser indicada após aproximadamente 3 a 6 meses do tratamento bem-sucedido da perfuração, dependendo do tamanho da perfuração e do tipo de reparo.
Em geral, antes de qualquer colonoscopia de vigilância, é necessário reavaliar cuidadosamente a presença de condições específicas que favorecem a perfuração, incluindo aumento da idade, sexo feminino, baixo IMC, internação em unidade de terapia intensiva, internação, doença diverticular, doença de Crohn doença, obstrução como indicação para a colonoscopia primária e colonoscopia intervencionista invasiva. De fato, a colonoscopia é contraindicada sempre que os riscos para a saúde ou a vida do paciente superam os benefícios mais favoráveis do procedimento.
Após um fechamento endoscópico bem-sucedido, é aconselhável que a cirurgia acompanhe o paciente juntamente com o endoscopista. O tratamento endoscópico é continuado com o jejum, antibioticoterapia de amplo espectro e hidratação intravenosa. A observação cuidadosa dos sinais de irritação peritoneal e o monitoramento dos parâmetros inflamatórios bioquímicos (PCR e leucograma) são cruciais. Quando a dor desaparece e os parâmetros inflamatórios e a função intestinal normalizam, a dieta oral pode ser retomada. A duração da observação é subjetiva, mas obviamente relacionada ao estado do paciente e à resposta ao tratamento conservador (não cirúrgico) ou endoscópico. A duração média da permanência hospitalar após o manejo não cirúrgico da perfuração varia de 9 a 13 dias.
Uma dieta líquida pode começar dentro de 1 a 2 dias após o início do manejo conservador da perfuração, de acordo com o estado clínico do paciente (Grau de Recomendação 1C).
Uma dieta líquida pode ser iniciada imediatamente após o reparo endoscópico da perfuração, de acordo com o estado clínico do paciente (Grau de recomendação 1C).
O paciente tratado para perfuração deve ser monitorado clinicamente, por exames laboratoriais e exames de imagem. Clinicamente, sinais peritoneais, como dor abdominal, sensibilidade rebote e proteção muscular, bem como sinais de infecção, como febre, náusea, vômito, distensão abdominal e diarreia, devem ser registrados. A avaliação frequente do estado físico e dos sinais vitais deve ser completada por exames laboratoriais para leucócitos, PCR, Hb, ureia e eletrólitos. A tomografia computadorizada continua sendo a ferramenta mais precisa a ser realizada em caso de deterioração clínica, principalmente quando a necessidade de cirurgia está em questão e pode ser realizada antes da alta hospitalar para confirmar a resolução com o tratamento não cirúrgico ou cirúrgico.
Qual é o tipo e a duração recomendados da antibioticoterapia em pacientes submetidos a fechamento endoscópico bem-sucedido ou tratamento conservador da perfuração?
Em pacientes submetidos ao reparo endoscópico da perfuração, o controle da infecção geralmente é obtido com um curso de antibioticoterapia venosa de curto prazo (3 a 5 dias). Os antibióticos devem ser interrompidos se não houver sinais de inflamação sistêmica e/ou peritonite.
Considerando a composição da microbiota intestinal no intestino grosso, pacientes com perfuração colônica necessitam de cobertura antimicrobiana para bactérias gram-negativas e anaeróbias. Os organismos potencialmente infectantes em procedimentos colorretais são derivados do lúmen intestinal, Bacteroides fragilis e outros anaeróbios, bem como Enterobacteriaceae, como Escherichia coli, são as bactérias mais comuns.
Se houver qualquer sinal de um processo infeccioso em andamento, os antibióticos devem ser continuados. Uma TC abdominal é recomendada após 5 a 7 dias para excluir sinais residuais de peritonite ou formação de abscesso e para excluir a possível necessidade de intervenção cirúrgica.
Qual é o tipo e a duração recomendados da profilaxia antitrombótica em pacientes submetidos a fechamento endoscópico bem-sucedido ou tratamento conservador da perfuração?
A sepse está associada à ativação da coagulação sanguínea (hipercoagulabilidade) contribuindo para o tromboembolismo venoso (TEV). Pacientes com sepse abdominal podem apresentar risco aumentado de TEV devido às suas condições pré-mórbidas, intervenção cirúrgica, admissão de diagnóstico de sepse e eventos e exposições como cateterismo venoso central, exames e procedimentos invasivos e drogas que potencializam a imobilidade.
Em pacientes com PIC submetidos a procedimento cirúrgico, a tromboprofilaxia geralmente é recomendada durante a internação e posteriormente de acordo com a doença de base e comorbidades (Grau de Recomendação 1B).
Tratamento cirúrgico da perfuração colônica durante a colonoscopia
A cirurgia laparoscópica (laparoscopia exploradora) é mandatória no tratamento de pacientes com sinais de peritonite difusa e sepse, grandes perfurações, falha do tratamento conservador e na presença de algumas patologias concomitantes, como câncer colorretal ou pólipos não ressecados com alta suspeita de carcinoma.
A morbimortalidade perioperatória relacionada à cirurgia para perfuração colônica é considerável, com taxas de 21–44% e 7–25%, respectivamente. Pacientes particularmente frágeis, como idosos e com baixa pressão arterial pré-operatória (choque), têm maiores riscos de mortalidade. Assim, a seleção adequada de pacientes e procedimentos cirúrgicos são cruciais para limitar a morbimortalidade relacionada à cirurgia para perfuração colônica durante a colonoscopia.
Em geral, os achados intraoperatórios determinam a melhor técnica a ser aplicada de acordo com os diferentes cenários. Os procedimentos cirúrgicos incluem sutura da perfuração, ressecção em cunha, colostomia por exteriorização da perfuração e ressecção colônica com ou sem anastomose primária ou colostomia. A decisão quanto ao tipo de procedimento cirúrgico depende (a) do tamanho, localização e etiologia da perfuração; (b) a viabilidade do cólon e mesocólon circundantes; (c) o grau e o tempo de desenvolvimento da peritonite; (d) estado geral do paciente e presença de comorbidades; (e) a qualidade da preparação colônica; e (f) a presença de lesões residuais não ressecadas durante o procedimento de colonoscopia.
A decisão de qual procedimento realizar, portanto, depende de muitas variáveis, e deve ser feita após uma inspeção cuidadosa de todo o cólon e da cavidade abdominal. A laparoscopia permite visualizar o defeito na parede do cólon, seu tamanho e localização, principais fatores que influenciam a escolha do tratamento.
Se nenhuma lesão que exigiria ressecção cirúrgica for observada durante a colonoscopia, o tamanho da perfuração for pequeno e o cólon estiver saudável e bem perfundido, então um reparo primário laparoscópico pode ser realizado com segurança. Além disso, a exploração laparoscópica permite a aspiração e irrigação da cavidade peritoneal incluindo a coleta de material para cultura.
Para resumir, a laparoscopia exploratória é indicada para fins diagnósticos e terapêuticos, e dependendo da habilidade do cirurgião, existe potencial para procedimentos cirúrgicos definitivos, incluindo sutura do defeito, ressecção em cunha e ressecção segmentar com ou sem anastomose e/ou ostomia.
A laparoscopia exploratória tem uma morbidade e mortalidade significativamente menor em comparação com a laparotomia exploradora no cenário de emergência. A conversão de laparoscopia para laparotomia deve ser considerada sempre que necessário em relação à capacidade do operador de proceder laparoscopicamente, à viabilidade do tecido e ao estado do paciente (grau de recomendação 1C).
Recomendações:
- A melhor técnica cirúrgica para o manejo da PIC deve ser decidida após uma inspeção cuidadosa da cavidade abdominal e considerando a patologia colônica subjacente (grau de recomendação 2C).
- O reparo primário pode ser usado se os tecidos colônicos parecerem saudáveis e bem vascularizados, e uma aproximação das bordas da perfuração poder ser feita sem tensão (Grau de Recomendação 2C).
- A ressecção em cunha é viável se não implicar um estreitamento excessivo da luz do cólon (por exemplo, perfuração do ceco ou cólon sigmóide) (grau de recomendação 2C).
- A ressecção colônica está indicada se a perfuração for muito grande, as bordas parecerem desvitalizadas ou se houver avulsão do mesocólon adjacente (grau de recomendação 2C).
- Reparo com colostomia em estágios podem ser necessárias em casos de cirurgia tardia (> 24 h da colonoscopia), contaminação peritoneal extensa, comorbidades importantes ou deterioração do estado geral do paciente (ou seja, hemodinamicamente instável ou sepse) (Grau de recomendação 2C).
No caso de câncer de cólon perfurado, a cirurgia deve seguir os princípios oncológicos da ressecção do câncer.
O controle de danos é uma técnica cirúrgica originalmente utilizada na cirurgia do trauma que consiste em três etapas: (1) uma laparotomia inicial abreviada com o objetivo de controlar a hemorragia e a contaminação com fechamento abdominal temporário (TAC); (2) ressuscitação até a melhora da fisiologia; e (3) retornar à sala de cirurgia após 24–72 h para reparo definitivo da lesão e fechamento da parede abdominal.
A perfuração não tratada ou mal diagnosticada quase sempre progride para peritonite e sepse, resultando em morbidade grave e prognóstico muito ruim. Notavelmente, taxas de morbidade de até 43% e taxas de mortalidade de até 25% foram relatadas. Quase um quarto dos pacientes receberá um diagnóstico tardio, com incidência de 45% de peritonite fecal. O processo inflamatório resultante associado à peritonite limita claramente as opções operatórias, impossibilitando um procedimento de estágio único e resultando em desvio fecal (colostomia) em 38% dos pacientes com peritonite fecal. Vários estudos relataram que idade > 67 anos, escore ASA, lesões contusas, mau preparo intestinal e esteroides são fatores de risco para aumento da morbidade pós-operatória.
Acompanhamento após o tratamento com sucesso da perfuração cólica durante a colonoscopia
Existe alguma recomendação para realizar uma endoscopia de vigilância após o sucesso do tratamento da perfuração? Se houver, qual o tempo recomendado para isso?
Atualmente, não há estudos na literatura com foco nas indicações e no momento da endoscopia de vigilância após o tratamento bem-sucedido da perfuração. No entanto, com base nas evidências disponíveis e na experiência clínica, uma colonoscopia de vigilância pode ser realizada com base na indicação inicial (p. e considerando a relação risco-benefício da realização de um exame endoscópico.
Assim, em casos de perfuração durante uma colonoscopia cirúrgica (por exemplo, polipectomia, ressecção endoscópica da mucosa ou dissecção endoscópica da submucosa), uma colonoscopia de vigilância deve ser realizada de acordo com as diretrizes atuais para determinar se a ressecção durante a endoscopia primária foi completa.
A colonoscopia é especificamente contraindicada em casos de perfuração conhecida ou suspeita. Consequentemente, qualquer colonoscopia após o tratamento da perfuração deve ser realizada uma vez que a parede do cólon esteja completamente curada. Supondo que o tempo de cicatrização após o tratamento da perfuração seja comparável ao após suturas cirúrgicas ou anastomose, uma colonoscopia de vigilância pode ser indicada após aproximadamente 3 a 6 meses do tratamento bem-sucedido da perfuração, dependendo do tamanho da perfuração e do tipo de reparo.
Em geral, antes de qualquer colonoscopia de vigilância, é necessário reavaliar cuidadosamente a presença de condições específicas que favorecem a perfuração, incluindo aumento da idade, sexo feminino, baixo IMC, internação em unidade de terapia intensiva, internação, doença diverticular, doença de Crohn doença, obstrução como indicação para a colonoscopia primária e colonoscopia intervencionista invasiva. De fato, a colonoscopia é contraindicada sempre que os riscos para a saúde ou a vida do paciente superam os benefícios mais favoráveis do procedimento.
Síndrome de coagulação pós-polipectomia
A síndrome de coagulação pós-polipectomia (também conhecida como síndrome pós-polipectomia, síndrome de eletrocoagulação pós-polipectomia e síndrome de queimadura transmural) refere-se ao desenvolvimento de dor abdominal localizada, febre e leucocitose (aumento dos leucócitos no sangue) na ausência de perfuração intestinal após a retirada de pólipos com eletrocautério.
O reconhecimento da síndrome de coagulação pós-polipectomia é importante para evitar cirurgia desnecessária, uma vez que o tratamento clínico é eficaz em quase todos os pacientes.
Ocorre em menos de 0,5% das colonoscopias com retirada de pólipos com eletrocautério.
Fatores associados ao risco aumentado da síndrome:
ᴥ» Tamanho do pólipo - Quanto maior o pólipo (≥ 10 mm), maior o risco da síndrome;
ᴥ» Forma do pólipo – Lesão não polipóide tem um maior risco síndrome;
ᴥ» Localização da lesão - Lesões no cólon ascendente e no ceco parecem ter taxas mais altas de complicações, incluindo a síndrome pós-polipectomia, e isso se deve a espessura da parede intestinal ser menor;
ᴥ» Pacientes com hipertensão arterial - O risco é maior nos pacientes hipertensos.
ᴥ» Tamanho do pólipo - Quanto maior o pólipo (≥ 10 mm), maior o risco da síndrome;
ᴥ» Forma do pólipo – Lesão não polipóide tem um maior risco síndrome;
ᴥ» Localização da lesão - Lesões no cólon ascendente e no ceco parecem ter taxas mais altas de complicações, incluindo a síndrome pós-polipectomia, e isso se deve a espessura da parede intestinal ser menor;
ᴥ» Pacientes com hipertensão arterial - O risco é maior nos pacientes hipertensos.
Algumas técnicas endoscópicas podem reduzir o risco da síndrome de coagulação pós-polipectomia:
ᴥ» Tracionar o pólipo em direção ao centro da luz, imediatamente antes da aplicação do eletrocautério, para que a mucosa seja afastada do restante da parede intestinal;
ᴥ» Injetar solução na submucosa para pólipos ≥ 10 mm;
ᴥ» Usar com mais frequência a polipectomia com alça a frio, isto é, sem usar o eletrocautério. Dados disponíveis sugerem ser uma opção segura e eficaz, mesmo para para lesões > 10 mm, localizadas no cólon direito e ceco.
ᴥ» Tracionar o pólipo em direção ao centro da luz, imediatamente antes da aplicação do eletrocautério, para que a mucosa seja afastada do restante da parede intestinal;
ᴥ» Injetar solução na submucosa para pólipos ≥ 10 mm;
ᴥ» Usar com mais frequência a polipectomia com alça a frio, isto é, sem usar o eletrocautério. Dados disponíveis sugerem ser uma opção segura e eficaz, mesmo para para lesões > 10 mm, localizadas no cólon direito e ceco.
Apresentação clínica
Tipicamente apresentam sintomas nas próximas 12 horas após a colonoscopia, mas podem ocorrer até sete dias depois. A maioria dos pacientes apresenta dor abdominal generalizada ou localizada na região do local da polipectomia. Febre e/ou taquicardia também podem estar presentes. O exame abdominal pode revelar sensibilidade abdominal localizada no local da polipectomia, mas alguns podem apresentar sinais e sintomas semelhantes a perfuração intestinal.
Diagnóstico
Deve-se suspeitar da síndrome de coagulação pós-polipectomia nos pacientes que apresentam dor e sensibilidade abdominal após a polipectomia com eletrocautério, particularmente após a remoção de pólipo grande (ou seja, ≥ 10 mm). Pode ser acompanhada por febre, taquicardia e leucocitose.
A tomografia computadorizada do abdome e da pelve (com contraste oral solúvel em água e contraste intravenoso) exclui a perfuração do cólon (ausência de ar livre no abdome). Podem ter espessamento focal da parede do cólon e/ou alteração da densidade da gordura em torno do cólon.
Para pacientes selecionados (por exemplo, aqueles com dor abdominal localizada leve, sem febre e sem taquicardia), pode ser razoável fazer o diagnóstico com base na apresentação clínica e sem exames complementares.
Tratamento
Pacientes selecionados podem ser tratados em regime ambulatorial se todas as condições a seguir forem atendidas:
ᴥ» Dor abdominal leve.
ᴥ» Pressão arterial, frequência cardíaca e respiratória normais e afebril.
ᴥ» Tomografia computadorizada abdominal e pélvica não mostra sinais de perfuração ou outras complicações graves.
ᴥ» Dor abdominal leve.
ᴥ» Pressão arterial, frequência cardíaca e respiratória normais e afebril.
ᴥ» Tomografia computadorizada abdominal e pélvica não mostra sinais de perfuração ou outras complicações graves.
O tratamento ambulatorial
Consiste no antibiótico oral por sete dias e uma dieta sem resíduos. Os pacientes são reavaliados clinicamente em dois a três dias. Se os sintomas melhorarem (por exemplo, sem dor abdominal ou febre), a dieta é liberada. Se a condição do paciente não melhorar ou piorar, a internação é necessária.
Antibiótico Oral
A queimadura da parede intestinal pode causar ruptura na barreira de defesa. Devem cobrir a flora gastrointestinal usual, bastonetes gram-negativos e anaeróbios.
ᴥ» Ciprofloxacino (500 mg de 12/12 horas) com metronidazol (500 mg de 8/8 horas).
ᴥ» Levofloxacino (750 mg ao dia) com metronidazol (500 mg de 8/8 horas).
ᴥ» Amoxicillina-clavulanato (875 mg amoxicillina e 125 mg clavulanato) de 8/8 horas.
Dieta
Dieta sem resíduos até que possam ser reavaliados em dois ou três dias. A dieta pode então ser liberada para uma dieta regular se melhorar clinicamente (sem dor ou sensibilidade abdominal).
Antibiótico Oral
A queimadura da parede intestinal pode causar ruptura na barreira de defesa. Devem cobrir a flora gastrointestinal usual, bastonetes gram-negativos e anaeróbios.
ᴥ» Ciprofloxacino (500 mg de 12/12 horas) com metronidazol (500 mg de 8/8 horas).
ᴥ» Levofloxacino (750 mg ao dia) com metronidazol (500 mg de 8/8 horas).
ᴥ» Amoxicillina-clavulanato (875 mg amoxicillina e 125 mg clavulanato) de 8/8 horas.
Dieta
Dieta sem resíduos até que possam ser reavaliados em dois ou três dias. A dieta pode então ser liberada para uma dieta regular se melhorar clinicamente (sem dor ou sensibilidade abdominal).
Tratamento hospitalar
A hospitalização é necessária para os demais pacientes.
Dieta
Depende da gravidade dos sintomas, jejum (repouso intestinal completo) ou dieta sem resíduos. A resolução da dor abdominal ocorre em dois a três dias, quando a dieta é progredida.
Antibióticos venosos
A escolha depende da gravidade da doença.
Metronidazol 500 mg IV cada 8 horas + Ceftriaxona 2g IV uma vez ao dia ou Cefotaxima 2g IV a cada 8 horas ou Ciprofloxacina 400 mg IV a cada 12 horas ou Levofloxacina 750 mg IV uma vez ao dia.
Os antibióticos intravenosos devem ser continuados até que a dor abdominal desapareça, geralmente de dois a três dias, quando troca para antibióticos orais (por exemplo, ciprofloxacina com metronidazol ou monoterapia com amoxicilina-clavulanato), para completar um curso de sete.
Dieta
Depende da gravidade dos sintomas, jejum (repouso intestinal completo) ou dieta sem resíduos. A resolução da dor abdominal ocorre em dois a três dias, quando a dieta é progredida.
Antibióticos venosos
A escolha depende da gravidade da doença.
Metronidazol 500 mg IV cada 8 horas + Ceftriaxona 2g IV uma vez ao dia ou Cefotaxima 2g IV a cada 8 horas ou Ciprofloxacina 400 mg IV a cada 12 horas ou Levofloxacina 750 mg IV uma vez ao dia.
Os antibióticos intravenosos devem ser continuados até que a dor abdominal desapareça, geralmente de dois a três dias, quando troca para antibióticos orais (por exemplo, ciprofloxacina com metronidazol ou monoterapia com amoxicilina-clavulanato), para completar um curso de sete.
Cuidados subsequentes
Pacientes com melhora clínica podem receber alta com antibióticos orais para completar um curso de sete dias. Critérios para a alta hospitalar:
ᴥ» Normalização dos sinais vitais (isto é, resolução da febre, taquicardia e normalização da pressão arterial).
ᴥ» Resolução de dor abdominal.
ᴥ» Tolerância a dieta oral.
ᴥ» Normalização dos sinais vitais (isto é, resolução da febre, taquicardia e normalização da pressão arterial).
ᴥ» Resolução de dor abdominal.
ᴥ» Tolerância a dieta oral.
Pacientes que não melhoram
Se o paciente não melhorar ou piorar (por exemplo, aumento da dor abdominal ou leucocitose, ou desenvolvimento de peritonite difusa), é urgente a avaliação da cirurgia e nova tomografia computadorizada do abdome e da pelve é feita.
Se houver suspeita de perfuração do cólon com base no exame clínico (por exemplo, defesa abdominal e rigidez) e/ou exames de imagem mostrando ar extraluminal, o tratamento é direcionado para a perfuração do cólon.
|
É o sangramento no trato digestivo que se origina abaixo do ângulo de Treitz (junção do duodeno com o jejuno). A saída de sangue vermelho vivo sem fezes através do ânus (enterorragia) tem sua origem no cólon, reto ou ânus em 85 a 90% dos casos.
Predomina na terceira idade (acima dos 60 anos). Em cerca de 10% a origem não é encontrada.
ᴥ» Abaixo dos 60 anos: Doença diverticular do cólon; Doença inflamatória intestinal; Neoplasia; Ectasia Vascular. ᴥ» Acima dos 60 anos: Doença diverticular do cólon; Ectasia Vascular; Neoplasia. |
Exame Clínico
História, exame clínico (frequência cardíaca, pressão arterial e cor das mucosas) e exame proctológico. Afasta doenças anorretais (neoplasias e orificiais - hemorroidas responde por 9% das causas) e também para confirmar o aspecto do sangramento relatado pelo paciente.
A retossigmoidoscopia rígida pode ser realizada nos quadros estáveis, mas não elimina a necessidade de outros exames.
Exames Laboratoriais
|
Tipagem sanguínea, hemoglobina, hematócrito, uréia, creatinina, eletrólitos, glicemia atual e em jejum, coagulograma (TP, TTPA) e gasometria arterial. OBS: Hemoglobina imediata é de valor limitado na hemorragia aguda, pois são necessários de 24 a 48h para o organismo equilibrar o volume intravascular. Hemograma e coagulograma frequentes para avaliar necessidade de hemotransfusões e correção de coagulopatias.
|
Medidas Iniciais
- A prioridade é garantir as vias aéreas pérvias.
- Punção venosa no membro superior para coleta de sangue e infusão de soro fisiológico ou Ringer lactato e de concentrado de hemácias (hemotransfusão). O volume a ser infundido depende da perda estimada de sangue, da condição clínica e história de doença cardiovascular incluindo insuficiência cardíaca congestiva.
- Correção da coagulopatia (RNI>1,5 - transfusão de plasma fresco e aqueles com contagem de plaquetas < 50.000 - transfusão de plaquetas) e dos distúrbios eletrolíticos se presentes.
- Após 24 a 48 horas, com o equilíbrio do volume intravascular, o valor do hematócrito reduz-se. O hematócrito reduz-se aproximadamente 2 ou 3 pontos e a hemoglobina 1 ponto para cada 500 mililitros de sangue perdido. O objetivo é manter o hematócrito igual ou maior que 30 nos idosos e igual ou maior que 20 nos jovens saudáveis.
- A elevação da uréia/creatinina pode indicar gravidade do sangramento por refletir a intensidade da perda sanguínea e risco de insuficiência real aguda.
- Sondagem gástrica para ver o conteúdo, quando não apresentam hematêmese (vômitos de sangue) e têm dificuldade de acesso à endoscopia para afastar origem gastroduodenal.
- Acesso venoso central puncionando a veia jugular interna: para auxiliar a reposição volêmica e proporcionar a verificação periódica da pressão venosa central (PVC) nos casos de sangramento maciço e/ou instabilidade hemodinâmica
- Colocação de cateter vesical: nos pacientes com choque hipovolêmico, para monitorar a resposta da reposição de fluídos por meio da perfusão renal.
Colonoscopia
A colonoscopia é o exame inicial de escolha na investigação e tratamento em pacientes com hemorragia digestiva baixa aguda moderada e maciça.
A acurácia diagnóstica varia de 72% a 86% com morbidade de 0,3%. O preparo de cólon anterógrado (via oral) é o método de eleição por ser fácil, útil e não causar ressangramento ou aumentar a velocidade do mesmo. Geralmente utiliza-se 50 a 75% da dose usual pelo sangue na luz intestinal ser um laxante natural.
O melhor momento para realizar a colonoscopia é em 12 a 24 horas após a chegada no hospital. Embora a colonoscopia de urgência realizada nas primeiras 12 horas seja segura e eficiente, e está relacionada à redução do tempo de internação e diminuição dos custos hospitalares. Para a maioria dos profissionais a colonoscopia deve ser realizada assim que as condições clínicas, após as medidas iniciais, permitirem.
Quando o sangramento é muito importante e não se consegue compensar adequadamente o paciente a colonoscopia deve ser realizada no CTI com o paciente intubado e 1 hora após o término do preparo de cólon através da sonda gástrica associado a 1000 ml de clister glicerinado.
Tratamento endoscópico na hemorragia digestiva baixa colônica
Métodos de tratamento endoscópico da hemorragia digestiva colorretal
1- Terapia com Infiltração: adrenalina, etanolamina e álcool absoluto
a- Solução de adrenalina 1:10.000 (1ml 1:1.000 em 9ml de NaCl0,9%): punciona o território do vaso sangrante e injeta um volume o suficiente (pode chegar a 20ml) para provocar importante inchaço local com o objetivo não só da vasoconstrição da adrenalina, mas da consequente compressão do vaso sanguíneo pelo efeito mecânico. O efeito dura em torno de 24 horas, tempo suficiente para a trombose do vaso, na ausência de coagulopatia.
b- Solução de Etanolamina (Ethamolin®) 2%+ glicose a 50% ou álcool absoluto: neste caso é necessário identificar o ponto sangrante para injetar pequenos volumes (1 a 4 ml) somente em cima do vaso, para evitar aumentar a lesão e a reduzir o risco da perfuração. Posiciona a agulha tangencialmente à parede do cólon para que a solução seja injetada na submucosa quando ocorre a formação da “bolha”. A injeção na camada muscular pode acarretar perfuração tardia.
2- Terapia com Cauterização: cauterização bipolar e monopolar com heater probe e cauterização com gás de argônio
|
a- Cauterização monopolar com heater probe (sonda): a sonda é pressionado contra o ponto sangrante, interrompendo o fluxo de sangue, inicialmente através da pressão e por fim pela cauterização. Não tem sido recomendado devido à profundidade da cauterização, mesmo mais superficial que a sonda monopolar comum, existe o risco de perfuração.
|
|
c- Cauterização com gás de argônio: A eletrocoagulação com argônio (APC) é um método de cauterização eletrocirúrgico, monopolar, no qual é aplicada uma corrente de energia de alta frequência sem entrar em contato direto com o tecido. Essa energia é levada ao tecido pelo gás argônio ionizado. O risco de perfuração praticamente não existe.
|
|
3- Métodos mecânicos: clipe metálico. O uso de hemoclip tem como pré-requisito para utilização a identificação do ponto de sangramento. Método mais eficaz e definitivo utilizado nas hemorragias de qualquer etiologia. Aplica-se um pequeno clip metálico estrangulando e obliterando, completamente, o vaso sanguíneo causador da hemorragia. O clip permanece aderido e é envolvido pelo tecido cicatricial. O material do clip é inerte em relação ao organismo.
|
Doença Diverticular
Os divertículos são protrusões da mucosa através da parede do cólon, em pontos de menor resistência. É uma saliência parecida com a ponta de um dedo de luva.
Raramente antes da terceira década de vida, estima-se que aos 40 anos 5 a 10% e a partir da quinta década, mais de 50% após os 70 anos e 66% após a oitava. Não há predominância em relação ao sexo.
O sangramento é atribuído à lesão dos vasos que acompanham a herniação da mucosa (camada interna) que forma o divertículo.
1- Fezes ressecadas presas dentro do divertículo podem machucar o revestimento interno (mucosa) e o vaso sanguíneo, causando o sangramento.
2- Outra causa é o aumento progressivo do tamanho do divertículo e rompe o vaso.
1- Fezes ressecadas presas dentro do divertículo podem machucar o revestimento interno (mucosa) e o vaso sanguíneo, causando o sangramento.
2- Outra causa é o aumento progressivo do tamanho do divertículo e rompe o vaso.
Ao evacuar, ao invés de fezes, sai grande quantidade de sangue vermelho vivo sem outros sintomas, geralmente em pessoas com mais de 60 anos hipertensos e/ou diabéticos.
Ao evacuar, ao invés de fezes, sai grande quantidade de sangue vermelho vivo sem outros sintomas, geralmente em pessoas com mais de 60 anos hipertensos e/ou diabéticos.
A doença diverticular é a principal causa de sangramento intestinal baixo volumoso, cerca de 50%. Mais comuns em pessoas com diabetes, arteriosclerose, hipertensão arterial e coagulopatia por doenças ou em uso de anticoagulantes (varfarina sódica).
A colonoscopia de urgência (primeira 24 horas de início do sangramento) é a principal arma para o tratamento dos casos que não melhoram com o tratamento clínico. Recomenda-se fazer o preparo intestinal (dose menor) e fazer o exame quando não estiver saindo fezes.
a – Solução de adrenalina 1:10.000 (1ml 1:1.000 em 9ml de NaCl0,9%): punciona o território do vaso sangrante e injeta um volume o suficiente (pode chegar a 20ml) para provocar importante ingurgitamento local com o objetivo não só da vasoconstrição da adrenalina, mas da consequente compressão do vaso sanguíneo pelo efeito mecânico. O efeito dura em torno de 24 horas, tempo suficiente para a trombose do vaso, na ausência de coagulopatia.
b – Cauterização bipolar: também de contato com efeito semelhante ao primeiro, mas a sonda bipolar impede a fuga de calor reduzindo a penetração tecidual e concentrando a coagulação no ponto sangrante reduzindo significativamente o risco de perfuração.
c – Métodos mecânicos: hemoclips metálicos. O uso de hemoclip tem como pré-requisito para utilização a identificação do ponto de sangramento. Método mais eficaz e definitivo utilizado nas hemorragias de qualquer etiologia. Aplica-se um pequeno clip metálico estrangulando e obliterando, completamente, o vaso sanguíneo causador da hemorragia. O clip permanece aderido e é envolvido pelo tecido cicatricial. O material do clip é inerte em relação ao organismo.
Ectasia Vascular Adquirida do Cólon
A ectasia vascular adquirida é a malformação vascular mais comum do cólon, geralmente entre 5 a 10 mm de diâmetro e múltiplas em 40 a 60% dos pacientes, mas tendem a se concentrar no mesmo segmento do cólon.
São alterações vasculares degenerativas adquiridas e decorre do envelhecimento da parede do intestino. Predominam em pessoas acima dos 60 anos, homens e mulheres, com pressão alta e/ou diabetes.
A abordagem das ectasias vasculares compreende três passos: diagnóstico da ectasia vascular como causa de sangramento; conversão da situação de urgência em eletiva (controle do sangramento); tratamento definitivo (endoscópico ou cirúrgico).
O achado casual de uma ectasia vascular em pacientes sem hemorragia digestiva baixa não determina necessidade de tratamento.
Alguns critérios são aplicados para definir a ectasia vascular como fonte de sangramento: detecção endoscópica de sangramento ativo oriundo da ectasia vascular; detecção de estigmas de hemorragia recente como coágulos, erosões ou sangue fresco próximo à ectasia vascular; paciente com hemorragia digestiva oculta, endoscopia digestiva alta e cápsula endoscópica ou enteroscopia normais, sendo, portanto a ectasia vascular não sangrante o único achado.
Definida a necessidade de tratamento, existem diversas modalidades terapêuticas usadas.
O tratamento endoscópico é o mais indicado. Existem diversas modalidades terapêuticas endoscópicas: eletrocoagulação com gás de argônio, eletrocoagulação bipolar ou "heater probe", escleroterapia e ligadura elástica.
As complicações aumentam à medida que aumenta a profundidade da lesão causada por estas modalidades. A eletrocoagulação por "heater probe" é a terapia associada com maior profundidade e, portanto, maior número de complicações.
Lesão de Dieulafoy colorretal
A lesão de Dieulafoy é um vaso submucoso aberrante dilatado com calibre de 1 a 3 mm (aproximadamente 10 vezes o normal) que corrói a mucosa que o cobre na ausência de úlcera primária. As lesões de Dieulafoy do cólon são extremamente raras, em torno de 2%.
A etiologia da lesão de Dieulafoy é desconhecida. Além disso, eventos que desencadeiam os sangramentos não são bem compreendidos. Os pacientes que sangram das lesões de Dieulafoy são tipicamente homens com comorbidades, incluindo doença cardiovascular, hipertensão, doença renal crônica, diabetes ou abuso de álcool.
O uso de AINEs também é comum entre pacientes com lesões de Dieulafoy; uma teoria é que os AINEs provocam sangramentos, causando atrofia das mucosas e lesões isquêmicas. Os episódios de sangramento geralmente são autolimitados, embora o sangramento possa ser recorrente e profuso.
A endoscopia é a modalidade diagnóstica de escolha para detectar a lesão de Dieulafoy e é particularmente útil quando realizada durante sangramento agudo. Isso ocorre porque o bombeamento arterial ativo pode ser visualizado em uma área sem úlcera ou lesão de massa associada.
Na ausência de sangramento ativo, a lesão de Dieulafoy pode aparecer como um mamilo aumentado ou vaso visível sem úlcera associada; no entanto, o vaso aberrante pode não ser visto, a menos que haja sangramento ativo no local. Como a lesão de Dieulafoy pode ser difícil de identificar, ela deve ser considerada no diagnóstico diferencial de sangramento sem uma fonte clara.
A hemostasia endoscópica pode ser obtida com uma combinação de injeção de adrenalina seguida de cauterização bipolar por sonda ou colocação de Clipe.
Outras abordagens usadas com sucesso no tratamento de lesões de Dieulafoy incluem cauterização por plasma de argônio e injeção de cianoacrilato.
A tatuagem endoscópica é útil para localizar a lesão para posterior retratamento endoscópico ou ressecção intra-operatória em cunha.
Se o ressangramento se repetir após um tratamento endoscópico, as opções terapêuticas incluem hemostasia endoscópica repetida, embolização angiográfica ou ressecção cirúrgica da cunha da lesão.
Uma abordagem endoscópica e laparoscópica combinada foi descrita; essa abordagem permite a localização precisa da lesão com endoscopia intraoperatória, seguida de uma ressecção cirúrgica laparoscópica limitada da cunha. A ressecção cirúrgica deve ser reservada para sangramentos de difícil controle.
Retite Actínica Crônica (Proctopatia Actínica Crônica)
Lesões no reto provocadas pela radiação (irradiação) da radioterapia para tratamento de cânceres da bexiga, do reto, da próstata, dos testículos e ginecológicos.
Retite Aguda: quase 50% dos pacientes apresentam sintomas durante o tratamento da radioterapia pélvica.
Retite crônica: em até 20% dos pacientes submetidos ao tratamento da radioterapia pélvica apresentará complicações em longo prazo. Além disso, entre 5 a 10% dos pacientes que desenvolveram lesão crônica do reto irão apresentar sangramento importante que requerem tratamento imediato com transfusões sanguíneas.
Irritação ou urgência retal e presença de muco e/ou sangue nas fezes, com ou sem evacuações frequentes com fezes amolecidas. A cauterização está indicada nos pacientes com sintomas moderados a graves que não responde ao tratamento clínico. O tratamento deve ser baseado no padrão e gravidade dos sintomas e na experiência do serviço.
Cauterização com gás de argônio.
|
|
A cauterização com gás de argônio (APC) é um método de cauterização monopolar, no qual é aplicada uma corrente de energia de alta frequência sem entrar em contato direto com o tecido. Essa energia é levada ao tecido pelo gás argônio ionizado. Potência de 50Watt com fluxo de 2,0 l/min e pulso de 0,5s. Intervalo entre as sessões de 3 a 4 semanas.
A maioria dos pacientes apresenta melhora no sangramento e da anemia após uma média de 3 sessões. Todas as lesões vasculares visíveis devem ser cauterizadas em intervalos de quatro semanas.
|
Eletrocoagulação bipolar. Disponível no serviço.
O equipamento necessário está amplamente disponível e é relativamente barato. A aplicação tangencial da sonda causa lesões superficiais cauterizando as ectasias da proctopatia por radiação.
Pacientes com sangramento recorrente e anemia crônica devido a lesão induzida pela radiação são tratados, com números de sessões necessárias, até que o sangramento diminua significativamente.
Pacientes com sangramento recorrente e anemia crônica devido a lesão induzida pela radiação são tratados, com números de sessões necessárias, até que o sangramento diminua significativamente.
Eletrocoagulação bipolar. Disponível no serviço.
O equipamento necessário está amplamente disponível e é relativamente barato. A aplicação tangencial da sonda causa lesões superficiais cauterizando as ectasias da proctopatia por radiação. Pacientes com sangramento recorrente e anemia crônica devido a lesão induzida pela radiação são tratados, com números de sessões necessárias, até que o sangramento diminua significativamente.
O resultado é confirmado pela melhora contínua do hematócrito. Não existem grandes complicações. Cauterização endoscópica bipolar é executada com 10 a 15 W de potência usando a Probe de 7 Fr, pulsos de 2 segundos aplicadas nas ectasias vasculares até 2 cm da margem anal de forma radial.
Lesões com sinais de sangramento recente (coágulo aderido) ou ativo
Injeção de adrenalina associada à cauterização bipolar e/ou clipe endoscópico.
O uso de anti-inflamatório não esteroide, geralmente crônico e regular, pode causar úlceras, geralmente localizadas no ceco e cólon ascendente. As úlceras geralmente são arredondadas ou ovaladas, rasas e de bordas finas e pouco elevadas. A suspensão dos anti-inflamatórios pode resultar na regressão clínica e patológica resultando em cicatrização das lesões em semanas ou até meses.
Pacientes que se apresentam na forma aguda com sangramento são geridos de acordo com sua condição clínica. Podem ser diagnosticados e tratados pela colonoscopia, mas pode ser um desafio, uma vez que muitas vezes é difícil diferenciar de outras doenças, especialmente doença inflamatória intestinal e câncer. Ocorre em pacientes com mais de 50 anos (média de 61 anos) em ambos os sexos.
Lesões com sinais de sangramento recente (coágulo aderido) ou ativo
O uso de anti-inflamatório não esteroide, geralmente crônico e regular, pode causar úlceras, geralmente localizadas no ceco e cólon ascendente. As úlceras geralmente são arredondadas ou ovaladas, rasas e de bordas finas e pouco elevadas. A suspensão dos anti-inflamatórios pode resultar na regressão clínica e patológica resultando em cicatrização das lesões em semanas ou até meses.
Pacientes que se apresentam na forma aguda com sangramento são geridos de acordo com sua condição clínica. Podem ser diagnosticados e tratados pela colonoscopia, mas pode ser um desafio, uma vez que muitas vezes é difícil diferenciar de outras doenças, especialmente doença inflamatória intestinal e câncer. Ocorre em pacientes com mais de 50 anos (média de 61 anos) em ambos os sexos.
Injeção de adrenalina associada à cauterização bipolar e/ou clipe endoscópico.
Durante o procedimento endoscópico, o cólon precisa estar completamente limpo, isto é, sem fezes e resíduos alimentares. Partículas de fezes ou de alimentos interferem na visualização adequada e na segurança do exame. Você receberá, junto com o preparo, o termo de consentimento para a realização da colonoscopia com todas as orientações em relação a realização do exame diagnóstico e dos procedimentos terapêuticos que poderão acontecer durante o procedimento.
Para a escolha do preparo intestinal da colonoscopia responda as seguintes perguntas:
1. Já fez a colonoscopia antes com preparo ruim?
2. Com que frequência vai ao banheiro evacuar? Demora mais de 4 dias?
3. Faz uso de antidepressivo?
4. Quem vai fazer a colonoscopia é diabético ou possui alguma limitação física como sequela de AVC, demência, doença de Parkinson ou uso de cadeira de rodas ou muleta/bengala?
1. Já fez a colonoscopia antes com preparo ruim?
2. Com que frequência vai ao banheiro evacuar? Demora mais de 4 dias?
3. Faz uso de antidepressivo?
4. Quem vai fazer a colonoscopia é diabético ou possui alguma limitação física como sequela de AVC, demência, doença de Parkinson ou uso de cadeira de rodas ou muleta/bengala?
Preparo Especial de Urgência
Você se esqueceu de iniciar o preparo na VÉSPERA! Não se desespere, ainda pode realizar o exame, mas seja rápido e entre em contato com a CLÍNICA ENDOCOLONO.
BAIXE PREPARO ESPECIAL DE URGÊNCIA AQUI!⟱
BAIXE PREPARO ESPECIAL DE URGÊNCIA AQUI!⟱
Pacientes com Colostomia
1. Preparo para pacientes com COLOSTOMIA sem o coto retal: fazer o preparo igual aos pacientes SEM colostomia.
2. Preparo para pacientes com COLOSTOMIA com o coto retal: fazer o preparo igual aos demais pacientes, mas realizar também a lavagem do coto retal com o Fleet enema ou Phosfoenema---130ml---2 unidades.
BAIXE A RECEITA AQUI!
2. Preparo para pacientes com COLOSTOMIA com o coto retal: fazer o preparo igual aos demais pacientes, mas realizar também a lavagem do coto retal com o Fleet enema ou Phosfoenema---130ml---2 unidades.
BAIXE A RECEITA AQUI!
Você pode marcar a a sua colonoscopia pelo telefone fixo, WhatsApp e e-mail.
VEJA AQUI TUDO SOBRE A COLONOSCOPIA⇒
COLONOSCOPIA - Aqui você tem, para o particular, o melhor valor "colonoscopia em Belo Horizonte"!
Telefones (31) 2510-3311 / 2510-3355.
VEJA AQUI TUDO SOBRE A COLONOSCOPIA⇒
COLONOSCOPIA - Aqui você tem, para o particular, o melhor valor "colonoscopia em Belo Horizonte"!
Telefones (31) 2510-3311 / 2510-3355.
Avenida dos Andradas 3323, 8º andar, esquina com Avenida do Contorno 2511. Santa Efigênia. Belo Horizonte. MG.
WhatsApp: EndoColono-(31)98299-1128
WhatsApp: Dr. Derival-(31)99217-3218 MAPA - COMO CHEGAR!
e-mail: [email protected]
WhatsApp: EndoColono-(31)98299-1128
WhatsApp: Dr. Derival-(31)99217-3218 MAPA - COMO CHEGAR!
e-mail: [email protected]
Isenção de responsabilidade
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.
As informações contidas neste artigo são apenas para fins educacionais e não devem ser usadas para diagnóstico ou para orientar o tratamento sem o parecer de um profissional de saúde. Qualquer leitor que está preocupado com sua saúde deve entrar em contato com um médico para aconselhamento.